Сульфид натрия (сульфид) – химическое соединение формулы Na2S. Его широко используют в бумажной и целлюлозной промышленности, а также при очистке воды для удаления тяжелых металлов.
| Название ИЮПАК | Сульфид натрия |
| Молекулярная формула | Na2S |
| Количество CAS | 1313-82-2 |
| Синонимы | Сульфид натрия, моносульфид натрия, сульфид динатрия, безводный сульфид натрия, негидратированный сульфид натрия, сульфид натрия |
| ИнЧИ | ИнЧИ=1S/2Na.S/q2*+1;-2 |
Молярная масса of сульфид натрия
Сульфид натрия имеет молярную массу 78,045 г/моль. Это значит, что в одном моле сульфида натрия содержится 78,045 грамма соединения. Молярная масса — это величина, полезная для расчета количества вещества, необходимого для реакции, а также для определения молекулярной массы соединения.
Температура кипения сульфида натрия
Сульфид натрия имеет относительно высокую температуру кипения >1180°C (2156°F). Это означает, что для преобразования твердой формы сульфида натрия в газовую форму требуется значительное количество энергии. Высокая температура кипения также указывает на то, что сульфид натрия является стабильным соединением при высоких температурах.
Температура плавления сульфида натрия
Сульфид натрия имеет температуру плавления 1180°C (2156°F). Это означает, что для преобразования твердой формы сульфида натрия в жидкую форму требуется значительное количество энергии. Высокая температура плавления сульфида натрия также указывает на то, что это стабильное соединение при высоких температурах.
Плотность сульфида натрия г/мл
Плотность сульфида натрия варьируется в зависимости от его формы. Безводная форма сульфида натрия имеет плотность 1,856 г/мл, а негидратная форма — 1,58 г/мл. Плотность вещества представляет собой массу единицы объема и является полезной величиной для определения концентрации раствора.
Молекулярный вес сульфида натрия
Молекулярная масса сульфида натрия составляет 78,045 г/моль. Это означает, что в одном моле сульфида натрия содержится 6,022 х 10^23 молекул соединения. Молекулярная масса — это величина, полезная для расчета количества вещества, необходимого для реакции, а также для определения молярной массы соединения.
Структура сульфида натрия
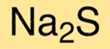
Сульфид натрия в безводной форме имеет кристаллическую структуру. Соединение образует бесцветные кристаллы, хорошо растворимые в воде. Структура соединения состоит из катионов натрия (Na+) и сульфид-анионов (S2-). Соединение имеет прочную ионную связь между ионами натрия и сульфида.
Формула сульфида натрия
Химическая формула сульфида натрия – Na2S. Это означает, что каждая молекула сульфида натрия содержит два катиона натрия и один сульфид-анион. Формула полезна для понимания химического состава соединения и определения его свойств.
| Появление | Твердое вещество от желтого до желто-коричневого цвета, расплывающееся |
| Удельный вес | 1,856 (безводный), 1,58 (нонагидрат) |
| Цвет | От бесцветного до желтого |
| Запах | Запах тухлых яиц |
| Молярная масса | 78,045 г/моль |
| Плотность | 1,856 г/мл (безводный), 1,58 г/мл (нонагидрат) |
| Точка плавления | 1180°С (2156°Ф) |
| Точка кипения | >1180°С (2156°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в этаноле, глицерине. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Щелочная, pH ~12 |
Безопасность и опасность сульфида натрия
Сульфид натрия может представлять несколько рисков для безопасности. Он очень вступает в реакцию с водой и при контакте может вызвать сильное раздражение кожи и глаз. Вдыхание соединения может вызвать раздражение дыхательных путей, а при проглатывании вызвать тошноту, рвоту и диарею. Соединение также легко воспламеняется и может бурно реагировать с окислителями. Важно обращаться с сульфидом натрия осторожно и носить соответствующие защитные средства, такие как перчатки и очки. При работе с составом также следует обеспечить достаточную вентиляцию. В случае заражения следует немедленно обратиться за медицинской помощью.
| Символы опасности | Коррозионный, Токсичный |
| Описание безопасности | Не вдыхать пыль/дым/газ/туман/пары/спрей. Надевайте защитные перчатки/защитную одежду/защиту глаз/лица. ПРИ ВДЫХАНИИ: Вынесите пострадавшего на свежий воздух и обеспечьте покой в удобном для дыхания положении. ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскание. ПРИ ПОПАДАНИИ НА КОЖУ (или волосы): Немедленно снимите всю загрязненную одежду. Промойте кожу водой/душем. ПРИ ПРОГЛАТЫВАНИИ: Прополоскать рот. Не вызывает рвоту. Немедленно позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу. |
| Идентификаторы сети | ООН1849 |
| код ТН ВЭД | 2830.10.00 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | Очень токсичен; при проглатывании может вызвать серьезное раздражение кожи и глаз, раздражение дыхательных путей, тошноту, рвоту и диарею. Может быть смертельным при проглатывании. |
Методы синтеза сульфида натрия
Существует несколько методов синтеза сульфида натрия:
Распространенным методом является реакция гидроксида натрия (NaOH) с серой (S) в высокотемпературной печи с образованием сульфида натрия (Na2S) и воды (H2O).
Другой метод включает взаимодействие диоксида серы (SO2) с сульфидом натрия (Na2S) с образованием тиосульфата натрия (Na2S2O3), а затем реакцию его с гидроксидом натрия (NaOH) с образованием сульфида натрия (Na2S) и воды (H2O).
Третий метод включает восстановление сульфата натрия (Na2SO4) углеродом в присутствии древесного угля при высоких температурах с образованием сульфида натрия (Na2S), углекислого газа (CO2) и угарного газа (CO).
Другой метод включает реакцию карбоната натрия (Na2CO3) с серой (S) в присутствии древесного угля при высоких температурах с образованием сульфида натрия (Na2S), диоксида углерода (CO2) и монооксида углерода. углерод (СО).
Для синтеза сульфида натрия нонагидрат сульфида натрия (Na2S.9H2O) можно ввести в реакцию с серной кислотой (H2SO4) с образованием сульфата натрия (Na2SO4) и диоксида серы (SO2). Затем нагрейте сульфат натрия с древесным углем, чтобы получить сульфид натрия (Na2S) и углекислый газ (CO2).
В целом существуют разные методы синтеза сульфида натрия, и выбор конкретного метода зависит от таких факторов, как желаемая чистота, количество и экономическая эффективность продукта.
Использование сульфида натрия
Сульфид натрия находит широкое применение в различных отраслях промышленности.
Кожевенная промышленность обычно использует его в качестве средства для депиляции для удаления волос и шерсти со шкур и шкур.
Он используется в качестве сульфурирующего агента при производстве серных красителей для текстиля и в качестве восстановителя при производстве других химикатов, таких как гидросульфит натрия.
В целлюлозно-бумажной промышленности сульфид натрия действует как отбеливатель и помогает удалить лигнин из древесной массы.
Он также используется в качестве флотационного агента в горнодобывающей промышленности для отделения медных, свинцовых и цинковых руд от пустой породы.
В промышленности по очистке сточных вод сульфид натрия используется в качестве восстановителя для удаления тяжелых металлов из сточных вод. Кроме того, он помогает в качестве дехлорирующего агента для удаления остаточного хлора в процессах очистки воды.
Фармацевтическая промышленность использует сульфид натрия при производстве некоторых лекарств и в качестве восстановителя в реакциях органической химии.
В лабораториях его используют как реагент в аналитической химии и как источник ионов серы в химическом синтезе.
В целом сульфид натрия представляет собой универсальное соединение, находящее различное применение в различных отраслях промышленности. Его уникальные химические свойства делают его полезным, среди прочего, в качестве восстановителя, средства для депиляции, флотационного агента и дехлорирующего агента.
Вопросы:
Вопрос: Каков заряд катиона в ионном соединении сульфида натрия?
Ответ: Катион сульфида натрия — натрий (Na+), имеющий заряд +1.
Вопрос: Какова формула сульфида натрия?
Ответ: Формула сульфида натрия — Na2S, которая представляет собой ионное соединение, образованное комбинацией катиона натрия (Na+) и сульфид-аниона (S2-).
Вопрос: Какова формула сульфида натрия?
Ответ: Формула сульфида натрия — Na2S, которая представляет собой ионное соединение, образованное комбинацией катиона натрия (Na+) и сульфид-аниона (S2-).
Вопрос: Растворим ли сульфид натрия?
Ответ: Сульфид натрия растворим в полярных растворителях, таких как вода и этанол, но нерастворим в неполярных растворителях, таких как бензол и хлороформ.
Вопрос: Растворим ли сульфид натрия в воде?
Ответ: Да, сульфид натрия хорошо растворим в воде, его растворимость составляет примерно 50 г/100 мл при комнатной температуре. Когда сульфид натрия растворяется в воде, он подвергается гидролизу с образованием гидроксида натрия и сероводорода.
