Сульфат аммония ((NH4)2SO4) — широко используемое удобрение, обеспечивающее растения необходимыми питательными веществами. Он также используется в антипиренах, при очистке белков и в качестве пищевой добавки.
| Название ИЮПАК | Тетраоксосульфат аммония (VI) |
| Молекулярная формула | (NH4)2SO4 |
| Количество CAS | 7783-20-2 |
| Синонимы | Сульфат аммония, сульфат аммония (2:1), сульфат диаммония, диаммонийная соль серной кислоты, маскагнит, Актамастер, Доламин |
| ИнЧИ | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Свойства сульфата аммония
Формула сульфата аммония
Формула сульфата аммония: (NH4)2SO4. Это означает, что одна молекула сульфата аммония содержит два иона аммония (NH4)+ и один сульфат-ион (SO4)2-. Ионы аммония и сульфат-ион удерживаются вместе ионными связями.
Молярная масса сульфата аммония
Молярная масса (NH4)2SO4 составляет 132,14 г/моль. Чтобы рассчитать молярную массу, нам нужно сложить атомные массы всех атомов в формуле. Атомные массы:
- Азот: 14,01 г/моль
- Водород: 1,01 г/моль
- Сера: 32,06 г/моль
- Кислород: 16,00 г/моль
Таким образом, молярная масса (NH4)2SO4 равна:
(2 х 14,01) + (8 х 1,01) + 32,06 + (4 х 16,00) = 132,14 г/моль
Температура кипения сульфата аммония
Температура кипения (NH4)2SO4 точно не определена, поскольку он разлагается до достижения точки кипения. При нагревании выше 235°С (NH4)2SO4 начинает терять воду и образовывать бисульфат аммония (NH4)HSO4. При нагревании выше 280°С бисульфат аммония далее разлагается на аммиак (NH3) и серную кислоту (H2SO4).
Сульфат аммония Температура плавления
Температура плавления (NH4)2SO4 составляет 235°С. Это температура, при которой (NH4)2SO4 переходит из твердого состояния в жидкое. Однако, как уже говорилось выше, (NH4)2SO4 также начинает разлагаться при этой температуре, поэтому не является чистой жидкой фазой.
Плотность сульфата аммония г/мл
Плотность (NH4)2SO4 составляет 1,77 г/мл при комнатной температуре и давлении. Это означает, что один миллилитр (NH4)2SO4 весит 1,77 грамма. Плотность вещества зависит от его температуры и давления, поэтому в разных условиях она может незначительно меняться.
Молекулярный вес сульфата аммония
Молекулярная масса (NH4)2SO4 равна его молярной массе, которая составляет 132,14 г/моль. Молекулярная масса — это масса одного моля вещества, равная 6,022 х 10^23 молекул. Молекулярную массу также можно выразить в единицах атомной массы (а.е.м.), которые равны 1/12 массы атома углерода-12. В а.е.м. молекулярная масса (NH4)2SO4 составляет 132,14 а.е.м.
Структура сульфата аммония
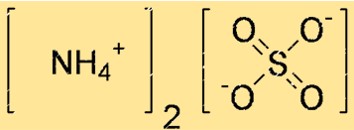
Структуру (NH4)2SO4 можно представить точечной структурой Льюиса или шаростержневой моделью. Точечная структура Льюиса показывает валентные электроны каждого атома и связи между ними. Шариковая модель показывает форму и размер каждого атома, а также связи между ними.
В приведенной выше структуре двойные линии (=) представляют двойные связи, одинарные линии (-) представляют собой одинарные связи, а точки (.) представляют неподеленные пары электронов.
Растворимость сульфата аммония
Растворимость (NH4)2SO4 — это количество (NH4)2SO4, которое может раствориться в данном количестве воды при данной температуре. Растворимость (NH4)2SO4 увеличивается с повышением температуры, о чем свидетельствуют следующие данные:
| Температура (°С) | Растворимость (г/100 мл воды) |
| 0 | 70,6 |
| Появление | Мелкие белые гигроскопичные гранулы или кристаллы. |
| Удельная плотность | 1,77 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 132,14 г/моль |
| Плотность | 1,77 г/см3 |
| Точка плавления | 235–280°C (разлагается) |
| Точка кипения | Не применимо (разложено) |
| Мигающая точка | Не воспламеняется |
| Растворимость в воде | 70,6 г на 100 г воды (0°С), 74,4 г на 100 г воды (20°С), 103,8 г на 100 г воды (100°С) |
| Растворимость | Нерастворим в ацетоне, спирте и эфире. |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | 5,5 (для иона аммония) |
| рН | 5 на 6 (для 5% раствора) |
Безопасность и опасность сульфата аммония
(NH4)2SO4 не очень опасен для здоровья человека, но при контакте или вдыхании может вызвать раздражение кожи, глаз, носа и горла. При проглатывании он также может вызвать тошноту, боль в животе, диарею, рвоту и сонливость. Он вреден для водной флоры и фауны, поэтому следует избегать его попадания в окружающую среду. Он разлагается при нагревании выше 235°C, образуя токсичные газы, такие как аммиак и серная кислота. Обычно он считается безопасным в качестве пищевой добавки, но у некоторых людей он может вызывать аллергические реакции или симптомы астмы.
| Символы опасности | Не обязательно |
| Описание безопасности | Избегать попадания в окружающую среду. Утилизируйте содержимое/контейнер в утвержденном пункте по утилизации отходов. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 31022100 |
| Класс опасности | Непригодный |
| Группа упаковки | Непригодный |
| Токсичность | LD50 (перорально, крыса) = 2,840 мг/кг |
Методы синтеза сульфата аммония
(NH4)2SO4 можно синтезировать различными методами, поскольку это неорганическая соль. Некоторые из распространенных методов:
- Нейтрализация аммиака и серной кислоты. Этот метод включает смешивание газообразного аммиака или водного раствора с серной кислотой и выпаривание воды с получением кристаллов (NH4)2SO4.
2NH3 + H2SO4 -> (NH4)2SO4
- Реакция карбоната аммония и гипса. Этот метод включает добавление мелкодисперсного гипса ( сульфата кальция ) к раствору карбоната аммония и фильтрацию осадка карбоната кальция.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Побочный продукт других процессов: различные промышленные процессы, такие как очистка коксового газа, производство капролактама, рафинирование никеля и десульфурация дымовых газов, могут производить (NH4)2SO4 в качестве побочного продукта. В этих процессах для удаления серы и других примесей из газовых потоков используется аммиак или соединения аммония, в результате чего (NH4)2SO4 становится отходом или ценным продуктом.
Применение сульфата аммония
(NH4)2SO4 представляет собой неорганическую соль, которая имеет различное применение, например:
- Щелочное удобрение для почвы: (NH4)2SO4 снижает pH почвы и обеспечивает азот и серу для роста растений. Подходит для культур, требующих кислых почв, таких как черника, картофель и томаты.
- Адъювант для сельскохозяйственного опрыскивания: (NH4)2SO4 повышает эффективность водорастворимых инсектицидов, гербицидов и фунгицидов за счет связывания ионов железа и кальция, которые могут препятствовать их действию. Он также улучшает усвоение растениями глифосата и других системных гербицидов.
- Очистка белков: (NH4)2SO4 может осаждать белки из водных растворов за счет увеличения ионной силы и снижения растворимости белков. Метод высаливания можно использовать для разделения белков по их размеру, заряду и гидрофобности.
- Пищевая добавка: в различных пищевых продуктах, таких как хлеб, сыр, вино и овощные консервы, используется (NH4)2SO4 в качестве регулятора кислотности, кондиционера для теста, питательного вещества для дрожжей и укрепляющего агента. FDA признает его в целом безопасным.
- Другие области применения: (NH4)2SO4 можно использовать для производства других солей аммония, огнетушителей, антипиренов, дубления кожи, крашения текстиля, гальваники металлов и аналитической химии.
Вопросы:
Вопрос: Какова химическая формула сульфата аммония?
Ответ: Химическая формула сульфата аммония: (NH4)2SO4. Это означает, что одна молекула сульфата аммония содержит два иона аммония (NH4)+ и один сульфат-ион (SO4)2-.
Вопрос: Растворим ли сульфат аммония?
A: (NH4)2SO4 растворим в воде, но нерастворим в ацетоне, спирте и эфире. Он может растворить 70,6 граммов на 100 граммов воды при 0°C, 74,4 граммов на 100 граммов воды при 20°C и 103,8 граммов на 100 граммов воды при 100°C.
Вопрос: Сколько сульфата аммония на галлон воды?
Ответ: Количество (NH4)2SO4 на галлон воды зависит от желаемой концентрации и температуры воды. Например, если желаемая концентрация составляет 10% (мас./об.) и температура воды 20°C, то количество (NH4)2SO4 на галлон воды составит:
10% (мас./об.) = 10 грамм на 100 мл воды 1 галлон = 3785,41 мл 10 грамм x 3785,41 мл / 100 мл = 378,54 грамма Следовательно, количество (NH4)2SO4 на галлон воды составляет 378,54 грамма.
Вопрос: Происходит ли реакция при соединении водных растворов сульфата аммония и хлорида кальция?
Ответ: Нет, при объединении водных растворов (NH4)2SO4 и хлорида кальция реакция не происходит. Действительно, обе соли растворимы в воде и не образуют нерастворимого осадка. Полученный раствор содержит четыре иона: аммония (NH4)+, сульфата (SO4)2-, кальция (Ca2+) и хлорида (Cl)-.
Вопрос: Как осаждать белки сульфатом аммония?
A: Для осаждения белков с помощью (NH4)2SO4 можно выполнить следующие шаги:
- Приготовьте водный раствор (NH4)2SO4 известной концентрации и объема.
- Медленно, помешивая, добавьте белковый раствор к раствору (NH4)2SO4.
- Контролируйте мутность или оптическую плотность смеси, чтобы определить количество белкового осадка.
- Центрифугируйте смесь, чтобы отделить осадок белка от супернатанта.
- Отбросьте супернатант и промойте белковый осадок буфером или водой, чтобы удалить избыток соли.
- Ресуспендируйте или солюбилизируйте белковый осадок в подходящем буфере для дальнейшего анализа или использования.
Вопрос: Сколько граммов содержится в 6,90 молекулах сульфата аммония?
Ответ: Чтобы узнать, сколько граммов содержится в 6,90 молекулах (NH4)2SO4, нам нужно использовать число Авогадро и молярную массу (NH4)2SO4. Число Авогадро равно 6,022 x 10^23, что означает, что в одном моле любого вещества содержится столько-то молекул. Молярная масса (NH4)2SO4 равна 132,14 г/моль, это означает, что один моль (NH4)2SO4 весит столько же граммов. Следовательно, мы можем использовать эту формулу для расчета, сколько граммов содержится в 6,90 молекулах (NH4)2SO4:
граммы = молекулы х молярная масса / число Авогадро граммы = 6,90 х 132,14 / 6,022 х 10^23 грамма = 1,52 х 10^-21. Следовательно, в 6,90 молекулах (NH4)2SO4 содержится 1,52 х 10^-21 грамм.
Вопрос: Сколько серы содержится в сульфате аммония?
A: (NH4)2SO4 содержит 24% серы по массе. Это можно рассчитать по формуле процентного состава и молярным массам серы и (NH4)2SO4. Молярная масса серы составляет 32,06 г/моль, а молярная масса (NH4)2SO4 составляет 132,14 г/моль. Следовательно, процент серы в (NH4)2SO4 составляет:
процент = молярная масса серы х 100 / молярная масса сульфата аммония процент = 32,06 х 100/132,14 процент = 24,26%
Вопрос: Какая из этих солей является нейтральной? na2so4 nacn kf (nh4)2so4
Ответ: Нейтральной солью считается та, которая не влияет на pH раствора при растворении в воде. Он образуется в результате реакции сильной кислоты и сильного основания. Из четырех приведенных солей только na2so4 является нейтральной солью. Он образуется в результате реакции гидроксида натрия (сильного основания) и серной кислоты (сильной кислоты). Другие соли являются кислыми или основными. Nacn — основная соль, образующаяся в результате реакции гидроксида натрия (сильное основание) и синильной кислоты (слабая кислота). Kf — основная соль, образующаяся в результате реакции гидроксида калия (сильное основание) и плавиковой кислоты (слабая кислота). (Nh4)2so4 — кислая соль, образующаяся в результате реакции гидроксида аммония (слабое основание) и серной кислоты (сильная кислота).
Вопрос: Какова молярная масса (nh4)2so4?
A: Молярная масса (nh4)2so4 составляет 132,14 г/моль. Чтобы найти молярную массу, нам нужно сложить атомные массы всех атомов в формуле. Атомные массы:
- Азот: 14,01 г/моль
- Водород: 1,01 г/моль
- Сера: 32,06 г/моль
- Кислород: 16,00 г/моль
Таким образом, молярная масса (nh4)2so4 равна:
(2 х 14,01) + (8 х 1,01) + 32,06 + (4 х 16,00) = 132,14 г/моль
Вопрос: Растворим ли (nh4)2so4 в воде?
О: Да, (nh4)2so4 растворим в воде. Он может растворять до 70,6 граммов на 100 граммов воды при 0°C, 74,4 граммов на 100 граммов воды при 20°C и 103,8 граммов на 100 граммов воды при 100°C.
