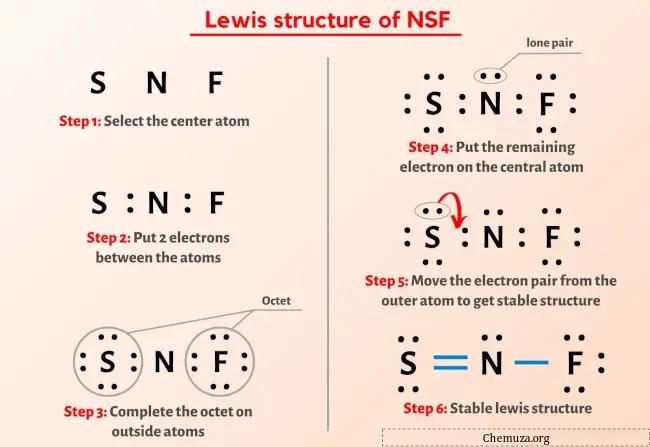
Итак, вы уже видели изображение выше, верно?
Позвольте мне кратко объяснить изображение выше.
Структура Льюиса NSF имеет атом азота (N) в центре, окруженный атомом серы (S) и атомом фтора (F). Между атомами азота (N) и серы (S) имеется двойная связь, а между атомами азота (N) и фтора (F) — одинарная.
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса NSF, оставайтесь со мной, и вы получите подробное пошаговое объяснение рисования структуры Льюиса NSF.
Итак, перейдем к этапам рисования структуры Льюиса NSF.
Этапы рисования структуры Льюиса NSF
Шаг 1: Найдите общее количество валентных электронов в молекуле NSF.
Чтобы найти общее количество валентных электронов в молекуле NSF, сначала необходимо знать валентные электроны, присутствующие в атоме азота, атоме серы, а также атоме фтора.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны азота, серы, а также фтора с помощью таблицы Менделеева.
Общее количество валентных электронов в молекуле NSF
→ Валентные электроны, отдаваемые атомом азота:
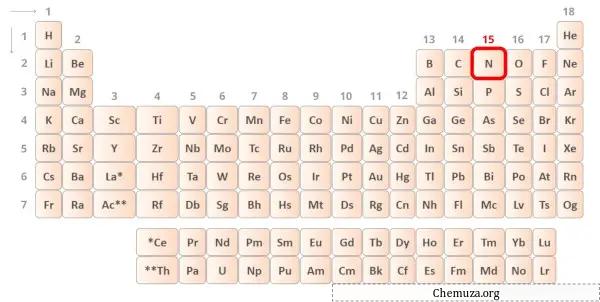
Азот — элемент 15-й группы таблицы Менделеева. [1] Следовательно, валентные электроны, присутствующие в азоте, равны 5 .

Вы можете увидеть 5 валентных электронов, присутствующих в атоме азота, как показано на изображении выше.
→ Валентные электроны, отдаваемые атомом серы:
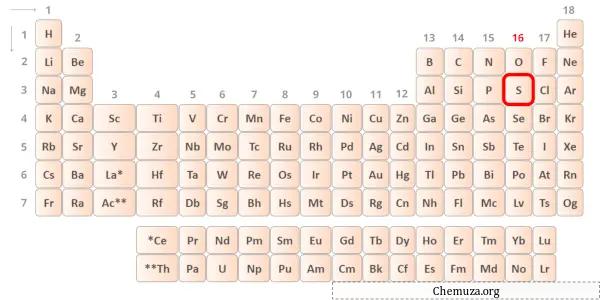
Сера — элемент 16-й группы таблицы Менделеева. [2] Следовательно, валентные электроны, присутствующие в сере, равны 6 .
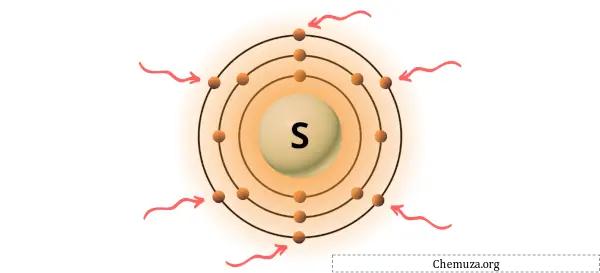
Вы можете увидеть 6 валентных электронов, присутствующих в атоме серы, как показано на изображении выше.
→ Валентные электроны, отдаваемые атомом фтора:
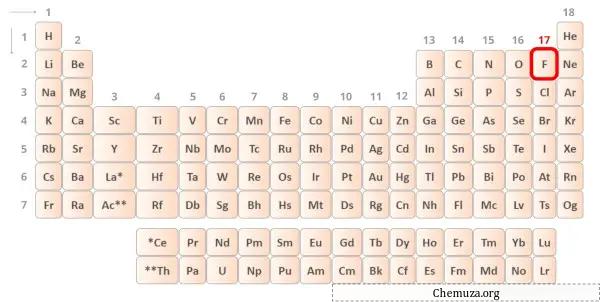
Флюорит — элемент 17 группы таблицы Менделеева. [3] Таким образом, валентный электрон, присутствующий во флюорите, равен 7 .
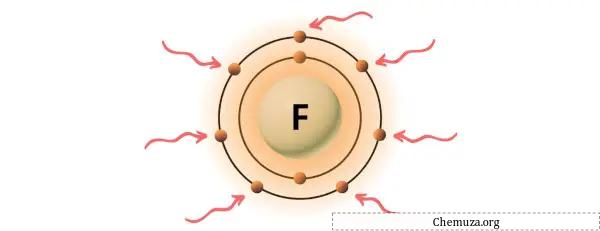
Вы можете увидеть семь валентных электронов, присутствующих в атоме фтора, как показано на изображении выше.
Так,
Общее количество валентных электронов в молекуле NSF = валентные электроны, пожертвованные 1 атомом азота + валентные электроны, подаренные 1 атомом серы + валентные электроны, подаренные 1 атомом фтора = 5 + 6 + 7 = 18 .
Шаг 2: Выберите центральный атом
Чтобы выбрать центральный атом, надо помнить, что в центре остается наименее электроотрицательный атом.
Теперь данная молекула является НФС и содержит один атом азота (N), один атом серы (S) и один атом фтора (F).
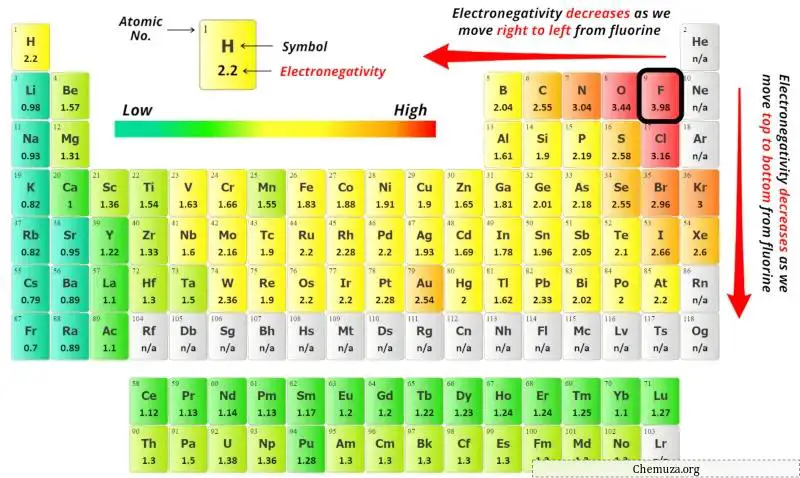
Значения электроотрицательности атома азота (N), атома серы (S) и атома фтора (F) вы можете увидеть в таблице Менделеева выше.
Если сравнить значения электроотрицательности атома азота (N), атома серы (S) и атома фтора (F), то атом азота менее электроотрицательен .
Здесь атом азота является центральным атомом, а атомы серы и фтора — внешними атомами.

Шаг 3: Соедините каждый атом, поместив между ними пару электронов.
Теперь в молекуле НФС нужно разместить электронные пары между атомом азота (N) и серы (S) и между атомом азота (N) и фтора (F).
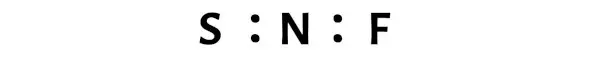
Это указывает на то, что эти атомы химически связаны друг с другом в молекуле NSF.
Шаг 4: Сделайте внешние атомы стабильными. Поместите оставшуюся пару валентных электронов на центральный атом.
На этом этапе вам необходимо проверить стабильность внешних атомов.
Здесь, на эскизе молекулы NSF, вы можете видеть, что внешние атомы — это атом серы и атом фтора.
Эти атомы серы и фтора образуют октет и поэтому стабильны.
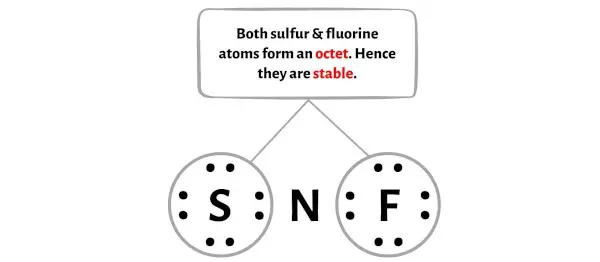
Кроме того, на этапе 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле NSF.
Молекула NSF имеет всего 18 валентных электронов , из них на диаграмме выше используются только 16 валентных электронов .
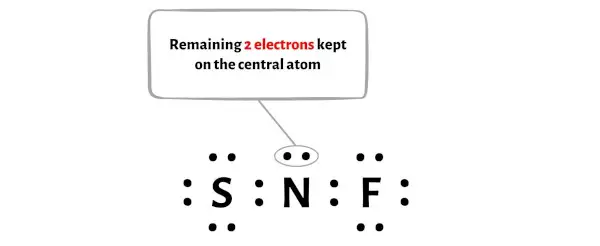
Таким образом, количество оставшихся электронов = 18 – 16 = 2 .
Вам нужно разместить эти 2 электрона на центральном атоме азота на приведенной выше схеме молекулы NSF.
Теперь перейдем к следующему шагу.
Шаг 5: Проверьте октет центрального атома. Если у него нет октета, переместите неподеленную пару, чтобы сформировать двойную или тройную связь.
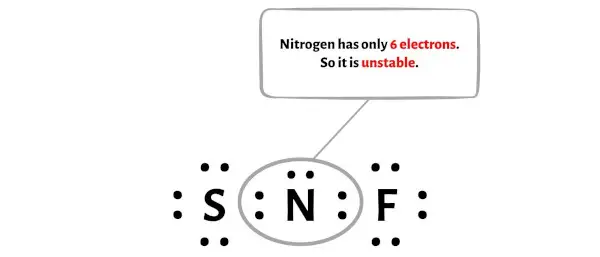
На этом этапе вам необходимо проверить, стабилен ли центральный атом азота (N) или нет.
Чтобы проверить стабильность центрального атома азота (N), нам нужно проверить, образует ли он октет или нет.
К сожалению, атом азота здесь не образует октет. Азот имеет всего 6 электронов и нестабилен.
Теперь, чтобы сделать этот атом азота стабильным, нужно сдвинуть электронную пару внешнего атома серы так, чтобы у атома азота было 8 электронов (т.е. один октет).
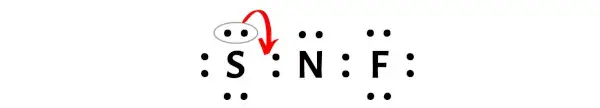
После перемещения этой пары электронов центральный атом азота получит еще 2 электрона, и общее количество электронов станет, таким образом, равным 8.
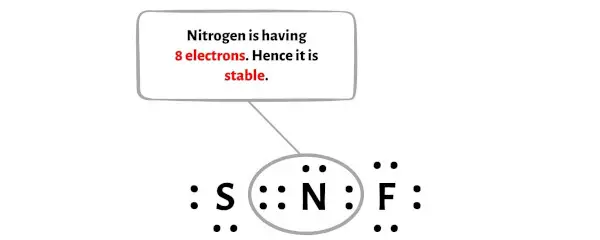
На изображении выше вы можете видеть, что атом азота образует октет, потому что у него 8 электронов.
Теперь перейдем к последнему шагу, чтобы проверить, стабильна ли структура Льюиса NSF или нет.
Шаг 6: Проверьте стабильность структуры Льюиса
Теперь вы подошли к последнему шагу, на котором вам необходимо проверить устойчивость конструкции Льюиса NSF.
Устойчивость структуры Льюиса можно проверить, используя формальное понятие заряда .
Короче говоря, теперь мы должны найти формальный заряд атомов азота (N), серы (S) и фтора (F), присутствующих в молекуле NSF.
Для расчета формального налога необходимо использовать следующую формулу:
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы NSF на изображении ниже.
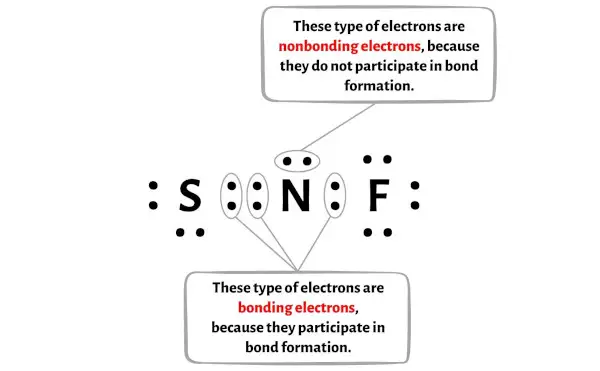
Для атома азота (N):
Валентные электроны = 5 (потому что азот находится в группе 15)
Связывающие электроны = 6
Несвязывающие электроны = 2
Для атома серы (S):
Валентные электроны = 6 (потому что сера находится в группе 16)
Связывающие электроны = 4
Несвязывающие электроны = 4
Для атома фтора (F):
Электронная валентность = 7 (потому что фтор находится в группе 17)
Связывающие электроны = 2
Несвязывающие электроны = 6
| Официальное обвинение | «=» | валентные электроны | – | (Связывание электронов)/2 | – | Несвязывающие электроны | ||
| НЕТ | «=» | 5 | – | 6/2 | – | 2 | «=» | 0 |
| С | «=» | 6 | – | 4/2 | – | 4 | «=» | 0 |
| Ф | «=» | 7 | – | 2/2 | – | 6 | «=» | 0 |
Из приведенных выше расчетов формального заряда вы можете видеть, что атом азота (N), атом серы (S), а также атом фтора (F) имеют «нулевой» формальный заряд.
Это указывает на то, что указанная выше структура Льюиса NSF стабильна и в указанной выше структуре NSF нет никаких других изменений.
В приведенной выше точечной структуре Льюиса NSF вы также можете представить каждую пару связывающих электронов (:) как одинарную связь (|). В результате получится следующая структура Льюиса NSF.
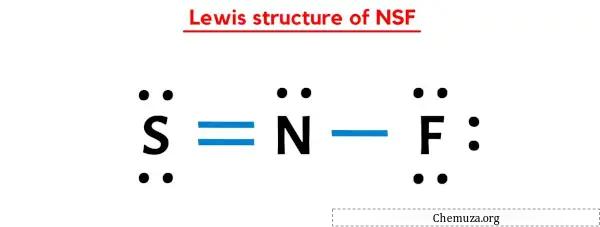
Надеюсь, вы полностью поняли все шаги, описанные выше.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
