Сероуглерод — летучее химическое соединение, образующееся в результате соединения углерода и серы. Он используется в промышленных процессах, растворителях и производстве вискозного волокна.
| Название ИЮПАК | Сероуглерод |
| Молекулярная формула | CS2 |
| Количество CAS | 75-15-0 |
| Синонимы | Сероуглерод, дитиокарб, сероуглерод |
| ИнЧИ | ИнЧИ=1S/CS2/c2-1-3 |
Свойства сероуглерода
Формула сероуглерода
Химическая формула сероуглерода — CS2. Он состоит из одного атома углерода и двух атомов серы, связанных вместе в линейном порядке. Эта простая формула необходима для понимания основного состава соединения.
сероуглерод Молярная масса
Молярная масса сероуглерода составляет примерно 76,14 г/моль. Для расчета сложим атомные массы одного атома углерода (12,01 г/моль) и двух атомов серы (32,06 г/моль каждый). Знание молярной массы помогает при различных химических расчетах.
Температура кипения сероуглерода
Сероуглерод имеет относительно низкую температуру кипения — около 46,3°C (115,3°F). Это свойство делает его летучим и легко испаряемым. Его низкая температура кипения важна в промышленных процессах и применениях, требующих быстрого испарения.
Температура плавления сероуглерода
Температура плавления сероуглерода составляет примерно -110,8°C (-187,4°F). Он остается в твердом состоянии при температурах ниже этой точки и переходит в жидкое состояние при нагревании. Понимание его точки плавления имеет решающее значение для обращения и хранения.
Плотность сероуглерода г/мл
Плотность сероуглерода составляет примерно 1,26 г/мл при комнатной температуре. Эта величина означает его массу в единице объема. Будучи более плотным, чем вода, он будет тонуть при смешивании, а его плотность будет влиять на его растворимость в различных растворителях.
Молекулярный вес сероуглерода
Молекулярная масса сероуглерода составляет примерно 76,14 г/моль, рассчитанная по его химической формуле. Эта величина играет важную роль в стехиометрии и определении количества соединения в химических реакциях.
Структура сероуглерода
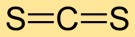
Сероуглерод имеет линейную молекулярную структуру с атомом углерода в центре и атомами серы по обе стороны. Это простое устройство имеет решающее значение для понимания его химического поведения и взаимодействия с другими веществами.
Растворимость сероуглерода
Сероуглерод плохо растворяется в воде, всего около 0,2 г на 100 мл воды при комнатной температуре. Однако он хорошо растворим в органических растворителях, таких как бензол и этанол. Такое поведение растворимости важно для различных применений в химии и промышленности.
| Появление | Бесцветная жидкость |
| Удельный вес | 1,26 |
| Цвет | Бесцветный |
| Запах | Острый и сладкий аромат |
| Молярная масса | 76,14 г/моль |
| Плотность | 1,26 г/мл |
| Точка плавления | -110,8°C (-187,4°F) |
| Точка кипения | 46,3°С (115,3°Ф) |
| Мигающая точка | -30°С (-22°Ф) |
| Растворимость в воде | 0,2 г/100 мл (20°С) |
| Растворимость | Растворим в органических растворителях, таких как бензол и этанол. |
| Давление газа | 318 мм рт.ст. (20°С) |
| Плотность пара | 2,62 (воздух = 1) |
| пКа | ~ -2 |
| рН | Нейтральный (pH 7) |
Безопасность и опасности сероуглерода
Сероуглерод представляет значительную угрозу безопасности. Он легко воспламеняется, и его пары могут образовывать взрывоопасные смеси в воздухе. Длительное воздействие может вызвать головокружение, головные боли и даже потерю сознания. Это также вредно для водных организмов и окружающей среды. Для минимизации рисков необходимы адекватная вентиляция, средства индивидуальной защиты и огнестойкое хранение. Избегайте контакта с кожей и глазами, так как это может вызвать раздражение и повреждение. Обращение должно происходить в хорошо контролируемых условиях, а разливы следует быстро локализовать. Понимание и соблюдение инструкций по технике безопасности имеет важное значение для предотвращения несчастных случаев и обеспечения безопасной рабочей среды при работе с сероуглеродом.
| Символы опасности | Легковоспламеняющийся, вредный |
| Описание безопасности | Легковоспламеняющаяся жидкость и пар. Вреден при вдыхании или проглатывании. Вызывает раздражение кожи и глаз. |
| Идентификационные номера ООН | ООН1131 |
| код ТН ВЭД | 2813.10.1000 |
| Класс опасности | 3 (Горючие жидкости) |
| Группа упаковки | II (Средняя опасность) |
| Токсичность | Умеренная токсичность |
Методы синтеза сероуглерода
Несколько активных методов позволяют синтезировать сероуглерод.
Распространенный метод включает реакцию серы с метаном или природным газом при высоких температурах, в результате чего в качестве продукта образуется CS2.
Другой подход заключается в реакции паров серы с горячим углем. Кроме того, сочетание окиси углерода и паров серы над катализатором также может привести к образованию сероуглерода.
Кроме того, прямой синтез CS2 может происходить при реакции углерода с парами серы при повышенных температурах. В лаборатории химики используют реакцию между ксантогенатом калия и серной кислотой для мелкомасштабного производства сероуглерода.
Каждый метод требует соответствующих мер предосторожности из-за легковоспламеняющейся и токсичной природы сероуглерода. Универсальность этих методов синтеза позволяет использовать их в различных отраслях промышленности, в том числе в качестве растворителя, сырья в химических процессах и при производстве вискозных волокон.
Использование сероуглерода
Сероуглерод находит разнообразное применение благодаря своим универсальным свойствам. Вот некоторые из его применений:
- Исследования и лабораторное применение: В лабораториях сероуглерод используется в качестве реагента для различных химических реакций, в том числе для синтеза металлоорганических соединений.
- Экстракция эфирных масел: сероуглерод находит применение при экстракции эфирных масел из растений, облегчая разделение желаемых ароматических соединений.
- Экстракция масла. Промышленность использует сероуглерод для извлечения масел из семян и овощей из-за его растворимости и низкой температуры кипения.
- Производство вискозного волокна: сероуглерод играет жизненно важную роль в производстве вискозного волокна, поскольку он помогает растворять целлюлозу, которую производители затем экструдируют для формирования синтетических волокон, используемых в текстиле.
- Промышленное применение: Сероуглерод используется в производстве пестицидов, фумигантов и химикатов для каучуков. Кроме того, он действует как катализатор при производстве серной кислоты и четыреххлористого углерода.
- Растворитель: Сероуглерод служит растворителем для различных веществ, включая масла, смазки, резину, смолы и серу. В результате его широко используют при производстве продуктов на основе целлюлозы.
- Химические процессы: служит сырьем для синтеза органических соединений, таких как четыреххлористый углерод, тиокарбаматы и дитиокарбаматы. Эти соединения находят применение в сельскохозяйственной и фармацевтической промышленности.
- Вулканизация резины: сероуглерод участвует в процессе вулканизации резины, улучшая ее прочность, эластичность и износостойкость.
Эти разнообразные применения подчеркивают важность сероуглерода во многих отраслях промышленности, от текстильной и сельскохозяйственной до научных исследований и производства.
Вопросы:
Вопрос: Какая из следующих молекул является полярной? A. аммиак B. октан c. вода д. сероуглерод
Ответ: а. Вода (H2O) полярна из-за своей изогнутой молекулярной формы и неравного распределения электронов.
Вопрос: Каков угол между связями углерод-сера в молекуле сероуглерода (CS2)?
A: Угол между связями углерод-сера в CS2 составляет 180 градусов, образуя линейную геометрию.
Вопрос: Сколько всего атомов содержится в 1 моле сероуглерода?
Ответ: Один моль сероуглерода содержит 6,02 х 10^23 молекул, каждая молекула имеет 3 атома (1 атом углерода и 2 серы).
Вопрос: Какой из этих элементов, по вашему мнению, будет растворим в неполярном растворителе, сероуглероде CS2?
Ответ: Неполярные вещества, такие как октан (b), должны быть растворимы в сероуглероде (CS2).
Вопрос: Какова нормальная температура кипения сероуглерода?
Ответ: Нормальная температура кипения сероуглерода составляет примерно 46,3°C (115,3°F).
Вопрос: Сероуглерод полярный или неполярный?
Ответ: Сероуглерод (CS2) является неполярной молекулой из-за своей линейной формы и равного распределения электронов.
Вопрос: Какова формула сероуглерода?
Ответ: Формула сероуглерода — CS2.
Вопрос: Что такое сероуглерод?
Ответ: Сероуглерод (CS2) — это летучее химическое соединение, состоящее из одного атома углерода и двух атомов серы, используемое в различных промышленных целях.
Вопрос: Насколько важен тот факт, что сероуглерод плотнее воды?
Ответ: Более высокая плотность сероуглерода по сравнению с водой означает, что он не легко смешивается и при объединении образует отдельные слои.
Вопрос: Как люди могут столкнуться с сероуглеродом?
Ответ: Люди могут вступить в контакт с сероуглеродом в ходе промышленных процессов, химических процессов или при работе с определенными продуктами.
Вопрос: Что произойдет, если вы проглотите сероуглерод?
Ответ: Проглатывание сероуглерода может вызвать проблемы со здоровьем, включая тошноту, головные боли и воздействие на нервную систему, что делает его опасным для здоровья человека.
Вопрос: Сероуглерод плотнее воды?
Ответ: Да, сероуглерод плотнее воды, его плотность составляет примерно 1,26 г/мл по сравнению с плотностью воды 1 г/мл.
