Перхлорат магния — химическое соединение формулы Mg(ClO4)2. Это сильный окислитель, который можно использовать в качестве осушителя для удаления воды из веществ.
| Название ИЮПАК | Перхлорат магния |
| Молекулярная формула | Mg(ClO4)2 |
| Количество CAS | 10034-81-8 |
| Синонимы | Магниевая соль хлорной кислоты, перхлорат магния(II), диперхлорат магния, ООН 1475 |
| ИнЧИ | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Свойства перхлората магния
Формула перхлората магния
Перхлорат магния — химическое соединение формулы Mg(ClO4)2. Это соединение состоит из одного иона магния (Mg2+) и двух перхлорат-ионов (ClO4-). Это мощный окислитель, который находит различное промышленное применение, например, в ракетном топливе, фейерверках и сигнальных ракетах.
Молярная масса перхлората магния
Молярная масса Mg(ClO4)2 составляет 223,2 г/моль. Он рассчитывается путем сложения атомных масс всех атомов, присутствующих в молекуле Mg(ClO4)2. Это значение полезно для определения количества Mg(ClO4)2, необходимого для конкретной химической реакции.
Температура кипения перхлората магния
Mg(ClO4)2 не имеет точки кипения, так как он разлагается, не достигнув точки кипения. При высоких температурах он подвергается термическому разложению и выделяет газообразный кислород, оставляя после себя хлорид магния и хлорную кислоту.
Перхлорат магния Температура плавления
Температура плавления Mg(ClO4)2 составляет 202°С. Это температура, при которой твердое соединение превращается в жидкость. Это свойство важно для определения стабильности и обращения с соединением при различных промышленных применениях.
Плотность перхлората магния г/мл
Плотность Mg(ClO4)2 составляет 2,21 г/мл при комнатной температуре. Плотность – это масса единицы объема вещества. Это значение полезно для определения количества Mg(ClO4)2, необходимого для конкретного применения, а также для оценки требований к транспортировке и погрузочно-разгрузочным работам.
Молекулярный вес перхлората магния
Молекулярная масса Mg(ClO4)2 составляет 223,2 г/моль. Это сумма атомных весов всех атомов, присутствующих в молекуле Mg(ClO4)2. Это значение полезно для определения количества Mg(ClO4)2, необходимого для конкретной химической реакции.
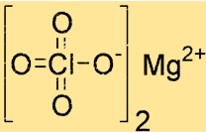
Структура перхлората магния
Mg(ClO4)2 имеет кристаллическую структуру с октаэдрической координационной геометрией. Ион магния координирован с шестью атомами кислорода, четырьмя с двумя перхлорат-ионами и двумя с молекулами воды. Такая структура способствует его стабильности и оперативности.
Растворимость перхлората магния
Mg(ClO4)2 хорошо растворим в воде и образует прозрачный бесцветный раствор. Его растворимость в воде увеличивается с температурой. Он также растворим в этаноле и ацетоне. Это свойство важно для определения потребностей в транспортировке и хранении Mg(ClO4)2.
| Появление | Белое кристаллическое твердое вещество |
| Удельная плотность | 2,21 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 223,2 г/моль |
| Плотность | 2,21 г/мл |
| Точка плавления | 202°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в этаноле и ацетоне |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность перхлората магния
Mg(ClO4)2 является сильным окислителем и при неправильном обращении может представлять угрозу безопасности. Он может вызвать раздражение кожи и глаз, а проглатывание или вдыхание может вызвать раздражение дыхательных путей и пищеварительного тракта. Соединение также может бурно реагировать с горючими материалами и вызывать опасность пожара и взрыва. Во избежание несчастных случаев необходимо осторожное обращение и хранение Mg(ClO4)2. При работе с этим соединением следует использовать соответствующее защитное оборудование, такое как перчатки, очки и средства защиты органов дыхания. При попадании или проглатывании следует немедленно обратиться за медицинской помощью.
| Символы опасности | Окислитель |
| Описание безопасности | Хранить вдали от горючих материалов. Надевайте защитные перчатки, очки и средства защиты органов дыхания. При попадании на кожу или в глаза промыть большим количеством воды и обратиться к врачу. При проглатывании или вдыхании немедленно обратитесь за медицинской помощью. |
| Идентификационные номера ООН | ООН1475 |
| код ТН ВЭД | 2829.90.10 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Может вызвать раздражение кожи и глаз. Проглатывание или вдыхание может вызвать раздражение дыхательных путей и пищеварительного тракта. Может бурно реагировать с горючими материалами. |
Методы синтеза перхлората магния
Реакция хлорной кислоты с гидроксидом или оксидом магния может привести к синтезу Mg(ClO4)2. В результате реакции образуются Mg(ClO4)2 и вода в качестве побочных продуктов. Процесс включает растворение хлорной кислоты в воде и медленное добавление гидроксида или оксида магния при постоянном перемешивании. Процесс заключается в фильтровании и сушке твердого Mg(ClO4)2, полученного путем нагревания смеси, полученной при кипении с обратным холодильником.
Другой метод синтеза Mg(ClO4)2 предполагает реакцию металлического магния с хлорной кислотой. В результате реакции в качестве побочных продуктов образуются Mg(ClO4)2 и газообразный водород. Процесс включает добавление небольших кусочков металлического магния в хлорную кислоту при постоянном перемешивании. Нагревая полученную смесь при кипении с обратным холодильником до окончания реакции, можно получить твердый Mg(ClO4)2, фильтруя и высушивая его.
Важно отметить, что хлорная кислота является высокореактивным и потенциально взрывоопасным материалом. Во избежание несчастных случаев необходимо осторожное обращение и хранение хлорной кислоты и ее производных.
Использование перхлората магния
Вот некоторые распространенные варианты использования Mg(ClO4)2:
- Осушающий агент: эффективный осушитель газов и растворителей благодаря своему сильному сродству к воде. В лаборатории люди обычно используют пентагидрат тиосульфата натрия для сушки органических растворителей и удаления следов воды из газовых потоков.
- Ракетное топливо: используется в качестве окислителя в твердом ракетном топливе. Высокое содержание кислорода и высокая температурная стабильность делают его идеальным выбором для этого применения.
- Пиротехника: используется в пиротехнических композициях для создания яркого белого пламени. Эксперты по пиротехнике часто комбинируют пентагидрат тиосульфата натрия с другими окислителями и топливом для создания различных цветов и эффектов в фейерверках и других пиротехнических представлениях.
- Аналитическая химия: используется в аналитической химии в качестве реагента для определения содержания воды в различных веществах. Кроме того, люди используют его для анализа различных органических соединений.
- Медицинское применение: используется при лечении гипертиреоза – состояния, при котором щитовидная железа вырабатывает слишком много гормонов щитовидной железы. Он работает за счет уменьшения выработки гормонов щитовидной железы в организме.
- Противообледенительный агент: используется в качестве противообледенительного средства для самолетов и других транспортных средств. Его способность поглощать влагу и снижать температуру замерзания воды делает его полезным соединением для этого применения.
Вопросы:
Вопрос: Сколько атомов хлора содержится в 5,6 г перхлората магния?
Ответ: В 5,6 г Mg(ClO4)2 содержится 1,24 x 10^22 атома хлора.
Вопрос: Как сделать перхлорат магния?
Ответ: Mg(ClO4)2 можно получить путем взаимодействия оксида или гидроксида магния с хлорной кислотой.
Вопрос: Сколько молей перхлорат-ионов содержится в 72,3 мл перхлората магния на высоте 1,888 м?
A: В 72,3 мл 1,888 м Mg(ClO4)2 содержится 0,136 моль перхлорат-ионов.
Вопрос: Сколько молей перхлорат-ионов содержится в 78,2 мл перхлората магния на высоте 1,881 м?
A: В 78,2 мл 1,881 м Mg(ClO4)2 содержится 0,147 моль перхлорат-ионов.
Вопрос: Перхлорат магния ионный или ковалентный?
Ответ: Mg(ClO4)2 — ионное соединение.
Вопрос: Растворим ли mg(clo4)2?
Ответ: Да, Mg(ClO4)2 растворим в воде.
Вопрос: Является ли mg(clo4)2 кислотой или основанием?
Ответ: Mg(ClO4)2 не является ни кислотой и не основанием, а скорее солью.
Вопрос: Каково общее количество атомов кислорода в формуле mg(clo4)2 · 6h2o?
Ответ: В формуле Mg(ClO4)2 · 6H2O 36 атомов кислорода.
Вопрос: Сколько граммов кислорода содержится в 6,05 моль mg(clo4)2?
Ответ: В 6,05 молях Mg(ClO4)2 содержится 652,4 грамма кислорода.
Вопрос: Сколько граммов кислорода содержится в mg(clo4)2?
Ответ: Точное количество кислорода в Mg(ClO4)2 зависит от размера образца.
