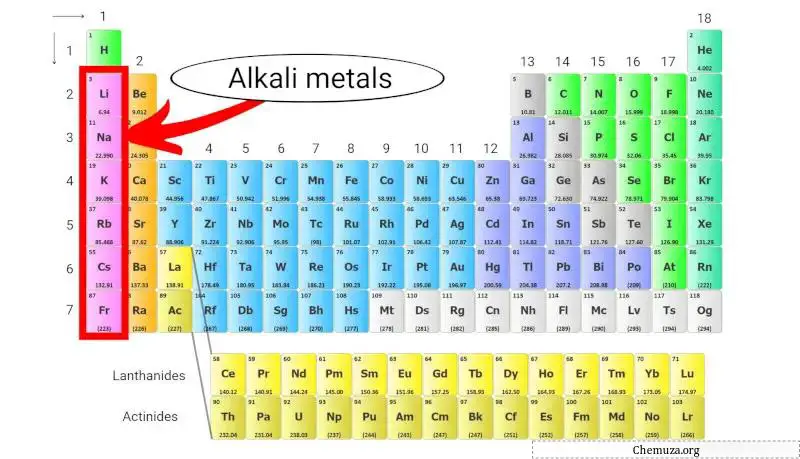
Щелочные металлы — группа химических элементов, расположенных в первом столбце таблицы Менделеева . В эту группу входят литий , натрий , калий , рубидий , цезий и франций .
Щелочные металлы мягкие и имеют низкие температуры плавления и кипения. Они обычно используются в батареях, сплавах и различных химических реакциях.
Давайте узнаем больше о щелочных металлах в таблице Менделеева.
Что такое щелочные металлы?

Щелочные металлы — это группа химических элементов таблицы Менделеева, относящихся к 1 группе .
Эти элементы известны своей мягкостью, низкой температурой плавления, высокой реакционной способностью и способностью образовывать щелочные растворы при взаимодействии с водой.
Некоторые из ключевых свойств щелочных металлов включают в себя:
- Они имеют низкую электроотрицательность и энергию ионизации, что означает, что они склонны легко терять электроны и образовывать катионы.
- Они имеют низкие температуры плавления и кипения, что делает их относительно мягкими и легко плавящимися.
- Они обладают высокой реакционной способностью по отношению к воде и кислороду, что делает их реакционноспособными в воздухе и воде.
- Они являются хорошими проводниками тепла и электричества.
Почему щелочные металлы так называются?

Щелочные металлы называются так потому, что при взаимодействии с водой они способны образовывать сильнощелочные (основные) растворы. [1]
Когда эти металлы вступают в контакт с водой, они выделяют газообразный водород и образуют ионы гидроксида, которые придают раствору основной pH .
Объяснение:
Реакционная способность щелочных металлов с водой обусловлена их низкой энергией ионизации [2] , что означает, что они способны легко терять электроны и образовывать положительные ионы (катионы).
Когда они вступают в контакт с водой, они подвергаются химической реакции, в которой теряют электроны и реагируют с молекулами воды с образованием ионов гидроксида и газообразного водорода.
Эта реакция выделяет много тепла, что может привести к воспламенению и взрыву газообразного водорода.
Порядок реакционной способности щелочных металлов
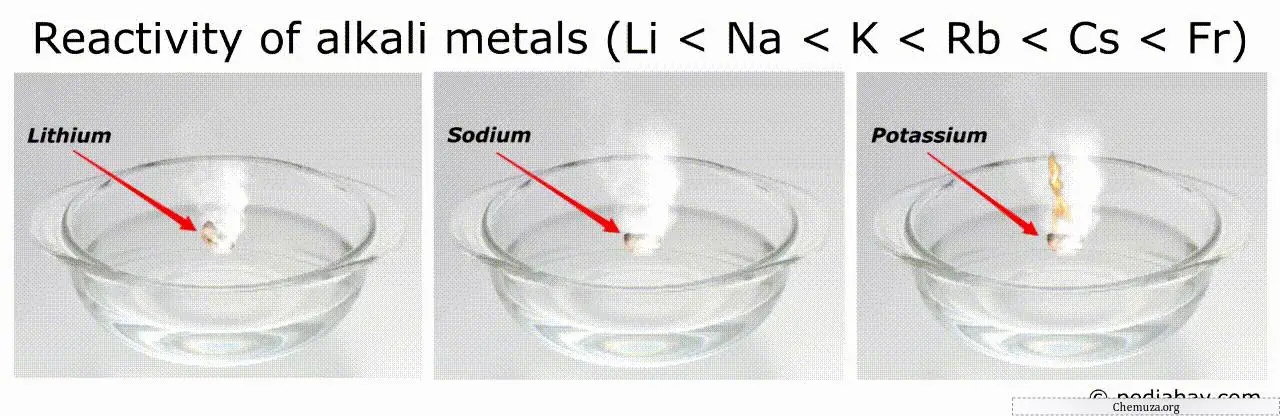
Общая тенденция в порядке реакционной способности щелочных металлов такова, что она увеличивается по мере продвижения по группе от лития (Li) к францию (Fr).
Это означает, что франций является наиболее реакционноспособным из всех щелочных металлов, а литий — наименее реакционноспособным.
Причина такой тенденции в том, что по мере движения вниз по группе атомный радиус элементов увеличивается, а энергия ионизации уменьшается.
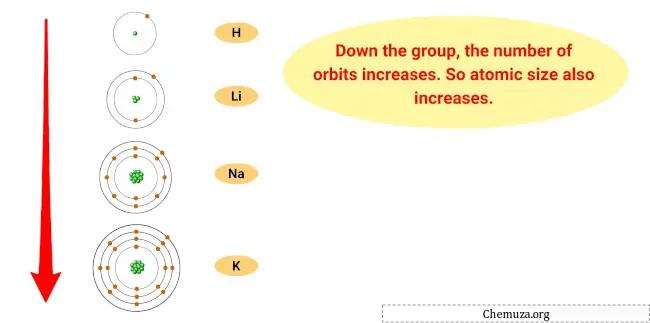
Это означает, что самый внешний электрон атома находится дальше от ядра и удерживается менее крепко, что облегчает элементу потерю этого электрона и превращение в катион.
Франций, будучи крупнейшим и наименее близким представителем группы, поэтому является наиболее реакционноспособным.
Этот порядок реакционной способности имеет важные последствия для свойств и поведения щелочных металлов.
Например, наиболее химически активные металлы (такие как франций и цезий) могут самопроизвольно воспламеняться на воздухе или в воде, что делает обращение с ними очень опасным.[3]
И наоборот, менее реакционноспособные металлы (например, литий) более стабильны и могут использоваться в приложениях, требующих более стабильного металла.
Список щелочных металлов и их электронные конфигурации
Щелочные металлы и их электронные конфигурации показаны ниже.
| Элемент | Электронная конфигурация |
| Литий (Li) | [Это] 2с 1 |
| Натрий (Na) | [Делать] 3с 1 |
| Калий (К) | [Ар] 4с 1 |
| Рубидий (Rb) | [Кр] 5с 1 |
| Цезий (Cs) | [Хе] 6с 1 |
| Франций (фр.) | [Рн] 7с 1 |
Периодические тенденции содержания щелочных металлов
Периодические тенденции содержания щелочных металлов упомянуты ниже:
- Тенденция валентности: валентность щелочных металлов всегда равна +1, что означает, что они имеют тенденцию терять электрон с образованием стабильного катиона. Поэтому при движении вниз по группе валентность щелочных металлов не меняется. Все они имеют одинаковую валентность (т.е. 1).
- Тенденция размера атомов: размер атомов щелочных металлов увеличивается по мере спуска по группе, а это означает, что атомы становятся больше. Это связано с тем, что по мере добавления энергетических уровней размер электронного облака увеличивается.
- Тенденция металлического характера: Металлический характер щелочных металлов увеличивается по мере спуска по группе. Это связано с тем, что металлы становятся более электроположительными и способны отдавать электроны для образования металлических связей.
- Тенденция электроотрицательности: электроотрицательность щелочных металлов уменьшается по мере спуска по группе. Это происходит потому, что атомы становятся больше, а внешние электроны находятся дальше от ядра, поэтому они меньше притягиваются к нему.
- Тенденция сродства к электрону: сродство щелочных металлов к электрону уменьшается по мере спуска по группе. Действительно, внизу группы размер атомов увеличивается, что уменьшает склонность атома принять электрон. (Подробнее о тенденции сродства к электрону читайте здесь, для более детального понимания).
- Тенденция энергии ионизации: энергия ионизации щелочных металлов уменьшается по мере спуска по группе. Это означает, что электрон легче удалить из внешней оболочки атома, поскольку электроны находятся дальше от ядра и менее прочно удерживаются.
Краткое содержание
Щелочные металлы — группа химических элементов, известных своей мягкостью, низкой температурой плавления, высокой реакционной способностью и способностью образовывать щелочные растворы при взаимодействии с водой.
Порядок реакционной способности щелочных металлов увеличивается по мере движения вниз по группе от лития к францию из-за увеличения атомного радиуса и уменьшения энергии ионизации.
Периодические тенденции в щелочных металлах включают увеличение размера атомов и металлического характера по мере движения вниз по группе, а также уменьшение электроотрицательности, сродства к электрону и энергии ионизации.
Валентность щелочных металлов всегда равна +1, а их электронные конфигурации соответствуют модели [благородного газа] ns 1 .
