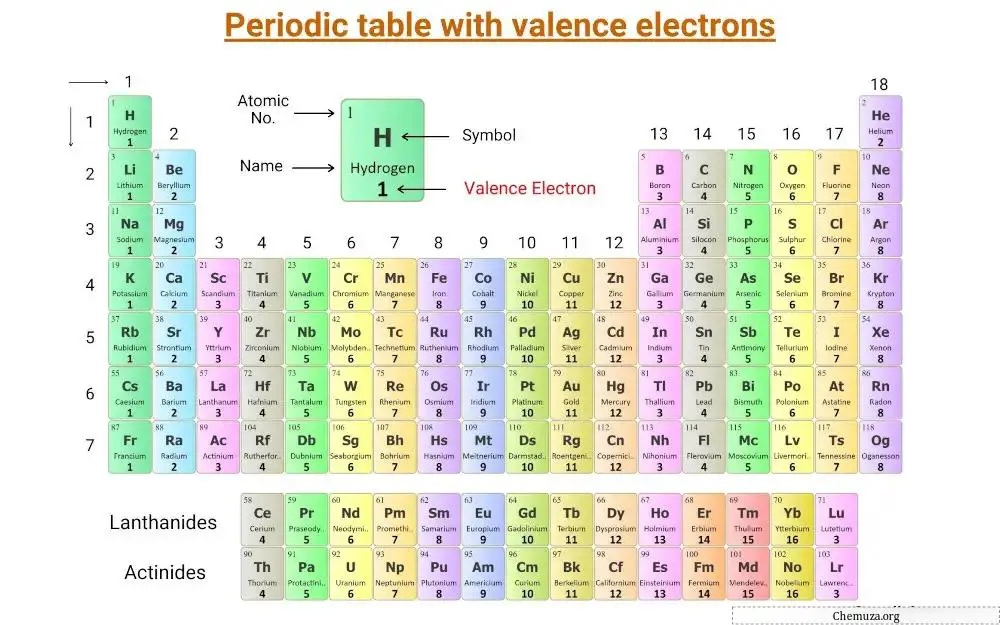
Это периодическая таблица , в которой отмечены валентные электроны.
Давайте разберемся в понятии валентных электронов , а также в количестве валентных электронов элементов основной группы и переходных элементов .
Что такое валентные электроны?
Валентные электроны — это электроны, расположенные на внешней оболочке или энергетическом уровне атома , которые участвуют в химической связи.
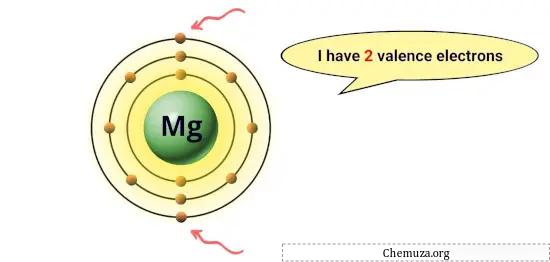
Например, у магния на внешней орбите 2 электрона, поэтому у него 2 валентных электрона. [1]
Эти электроны отвечают за химические свойства элемента, такие как его реакционная способность и типы химических связей, которые он может образовывать с другими атомами.
Число валентных электронов, которые имеет атом, определяет его положение в таблице Менделеева и его способность образовывать химические связи .
Валентные электроны элементов основной группы
Элементы основной группы, также называемые репрезентативными элементами, расположены в группах 1, 2 и с 13 по 18 периодической таблицы.
Число валентных электронов в этих элементах равно номеру их группы.
Например, элементы группы 1, такие как литий и натрий , имеют один валентный электрон, а элементы группы 2, такие как магний и кальций , имеют два валентных электрона.
Элементы 13-й группы, такие как бор и алюминий , имеют три валентных электрона и так далее.
Эти валентные электроны отвечают за уникальные химические свойства и реакционную способность элементов.
Валентные электроны переходных и внутренних переходных элементов
Валентные электроны переходных элементов и внутренних переходных элементов определить сложнее, чем электроны элементов основной группы.
Действительно, подслой d переходных элементов и подслой f внутренних переходных элементов заполнены не полностью и очень близки к внешнему подслою s.
В результате электроны подоболочек d и s в переходных элементах и подоболочек f и s во внутренних переходных элементах могут вести себя как валентные электроны.
Для переходных элементов число валентных электронов может варьироваться от 3 до 12 из-за вклада электронов d-подоболочки и s-подоболочки. В некоторых случаях электроны на неполных d-орбиталях также считаются валентными электронами. [2]
Точно так же для внутренних переходных элементов (или элементов f-блока) валентные электроны могут находиться в диапазоне от 3 до 16 из-за вклада электронов f-подоболочки и s-подоболочки. [3] Электроны на неполных d-орбиталях также можно считать валентными электронами в некоторых внутренних переходных металлах.
Важно отметить, что для переходных и внутренних переходных элементов валентными электронами являются электроны, находящиеся в оболочках вне ядра благородного газа.
