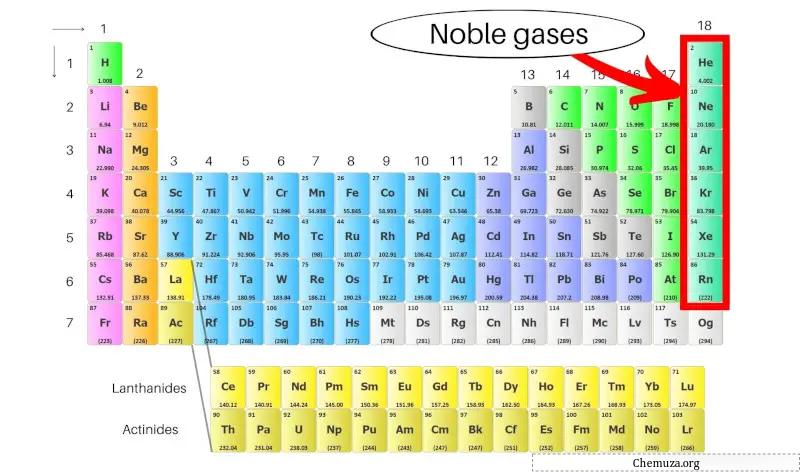
Благородные газы, также называемые инертными газами, представляют собой группу элементов, расположенных в крайнем правом столбце таблицы Менделеева . К ним относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn).
Эти элементы известны своей низкой реакционной способностью из-за их наиболее полных электронных оболочек, что делает их стабильными и нереакционноспособными по отношению к другим элементам. [1]
Давайте изучим больше благородных газов в таблице Менделеева.
Что такое благородные газы?
Благородные газы — это элементы 18-й группы , которые характеризуются очень низкой реакционной способностью с другими веществами, а это означает, что они обычно не образуют соединений с другими элементами.
Их еще называют инертными газами, поскольку они очень стабильны и трудно вступают в реакцию с другими веществами. Благородные газы включают гелий, неон, аргон, криптон, ксенон и радон.
Благородные газы встречаются в небольших количествах в атмосфере Земли и используются в различных областях, таких как освещение, сварка и криогеника. [2]
Почему благородные инертные газы?
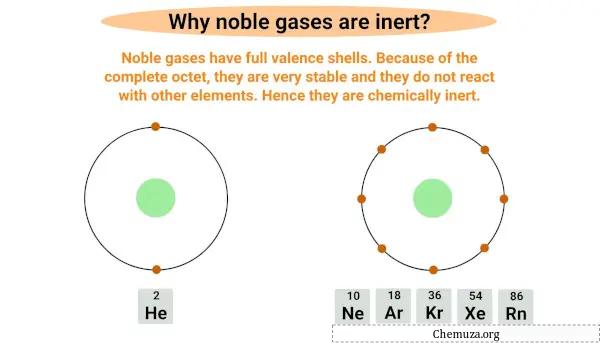
Благородные газы инертны или нереакционноспособны, поскольку имеют полную внешнюю электронную оболочку, также известную как валентная оболочка .
Валентная оболочка — это внешняя оболочка электронов, которая окружает атом и содержит его валентные электроны , которые являются электронами, участвующими в химических реакциях.
Благородные газы имеют полный октет , что означает, что они имеют полную валентную оболочку с восемью электронами, за исключением гелия, который имеет только два электрона на внешней оболочке.
Наличие полного байта делает их очень стабильными и маловероятными для взаимодействия с другими элементами.
В химических реакциях элементы имеют тенденцию приобретать или терять электроны, чтобы получить полный октет в своей валентной оболочке, но поскольку благородные газы уже имеют полную валентную оболочку, им не нужно приобретать или терять электроны.
Эта стабильная конфигурация инертных газов обусловлена их электронной конфигурацией.
Внешняя электронная оболочка этих элементов заполнена, поэтому им не нужно приобретать или терять электроны.
Это означает, что они очень инерционны и не склонны образовывать химические связи с другими элементами.
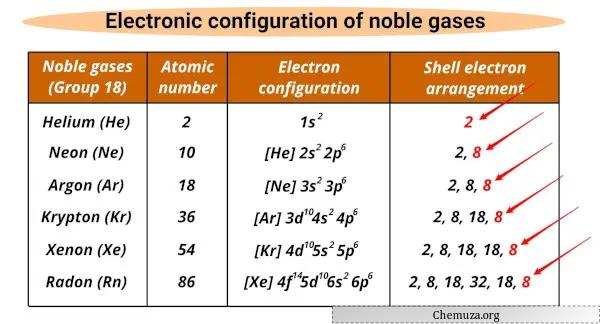
Список благородных газов и их электронные конфигурации
Благородные газы и их электронные конфигурации показаны ниже.
Что общего у всех благородных газов?
Благородные газы имеют некоторые общие свойства .
Все они имеют одинаковое количество валентных электронов (8), за исключением гелия, у которого их 2.
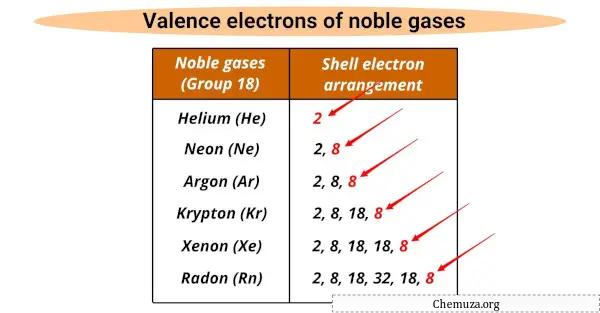
Валентные электроны — это самые внешние электроны в атоме, которые участвуют в химических реакциях, а благородные газы имеют полную валентную оболочку , что делает их нереакционноспособными.
Кроме того, благородные газы — это бесцветные газы, которые мы не можем видеть, а также они не имеют запаха , то есть не имеют запаха. [3]
Наконец, в природе они существуют как одноатомные газы, то есть в своей элементарной форме они содержат только один атом.
В отличие от большинства других элементов, которые имеют тенденцию образовывать молекулы путем связи с другими атомами, благородным газам не требуется связываться с другими атомами, поскольку они имеют полную валентную оболочку, что делает их очень стабильными и нереакционноспособными.
Краткое содержание
Благородные газы — это группа элементов, находящихся в крайнем правом столбце таблицы Менделеева, включая гелий, неон, аргон, криптон, ксенон и радон.
Они характеризуются низкой реакционной способностью из-за полностью внешних электронных слоев. Благородные газы инертны или нереакционноспособны, поскольку имеют полновалентную оболочку, что делает их очень стабильными и маловероятными для взаимодействия с другими элементами.
Благородные газы имеют общие свойства, в том числе одинаковое количество валентных электронов (8, за исключением гелия, у которого их 2), газ без цвета и запаха и в природе существуют как одноатомные газы.
Они используются в различных приложениях, таких как освещение, сварка и криогеника, а также в качестве теплоносителей в ядерных реакторах и в качестве наполнителей для ламп накаливания.
