Пероксид натрия (Na2O2) является сильным окислителем. Он бурно реагирует с водой с выделением кислорода и может воспламенить горючие материалы при контакте. Он используется в различных химических реакциях и в качестве дезинфицирующего средства.
| Название ИЮПАК | оксид натрия |
| Молекулярная формула | Na2O2 |
| Количество CAS | 1313-60-6 |
| Синонимы | Пероксид натрия, супероксид натрия, диоксид динатрия, биноксид натрия, диоксид натрия, NaO2, ООН 1507 |
| ИнЧИ | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
Свойства перекиси натрия
Формула перекиси натрия
Химическая формула перекиси натрия – Na2O2. Это ионное соединение, состоящее из двух катионов натрия (Na+) и пероксидного аниона (O22-). Формула пероксида натрия используется для представления химического состава соединения и важна в химических реакциях с участием этого вещества.
Молярная масса of пероксид натрия
Пероксид натрия, химическая формула Na2O2, имеет молярную массу 77,98 г/моль. Это ионное соединение, состоящее из двух катионов натрия (Na+) и пероксидного аниона (O22-). Молярная масса пероксида натрия важна для расчета количества соединения, необходимого для различных химических реакций.
Температура кипения перекиси натрия
Пероксид натрия имеет очень высокую температуру кипения — 657°C (1215°F), что делает его чрезвычайно стабильным при высоких температурах. Соединение разлагается, не достигнув точки кипения, выделяя газообразный кислород и оставляя оксид натрия. Высокая температура кипения пероксида натрия делает его полезным в высокотемпературных реакциях и промышленных процессах, где требуется высокая термическая стабильность.
Температура плавления перекиси натрия
Пероксид натрия имеет температуру плавления 675°C (1247°F), что относительно высоко по сравнению с другими распространенными веществами. Он плавится с образованием желтовато-белой жидкости и разлагается при температуре выше точки плавления с выделением газообразного кислорода и образованием оксида натрия. Высокая температура плавления пероксида натрия делает его полезным в химических реакциях при высоких температурах.
Плотность пероксида натрия г/мл
Плотность пероксида натрия составляет 2,805 г/мл. Это порошок от белого до желтоватого цвета, плотность которого превышает плотность воды. Высокая плотность пероксида натрия делает его полезным в различных промышленных процессах, таких как отбеливание, дезинфекция и производство других химикатов.
Молекулярный вес пероксида натрия
Пероксид натрия имеет молекулярную массу 77,98 г/моль. Это ионное соединение с двумя катионами натрия (Na+) и одним пероксидным анионом (O22-). Молекулярная масса пероксида натрия важна в химических реакциях с участием этого соединения, поскольку помогает определить количество реагентов и продуктов.
Структура перекиси натрия
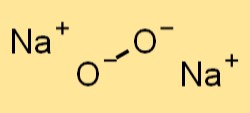
Пероксид натрия имеет кристаллическую структуру, аналогичную хлориду натрия (NaCl). Он образует гранецентрированную кубическую решетку, в которой ионы натрия занимают углы куба, а перекисные анионы расположены в центре каждой грани. Пероксидные анионы в пероксиде натрия удерживаются вместе ковалентными связями, а ионы натрия — ионными связями.
| Появление: | Белый или желтоватый порошок |
| Удельный вес: | 2805 г/см3 |
| Цвет: | От белого до желтоватого |
| Запах: | Без запаха |
| Молярная масса: | 77,98 г/моль |
| Плотность: | 2805 г/см3 |
| Точка слияния: | 675°С (1247°Ф) |
| Точка кипения: | 657°С (1215°Ф) |
| Точка возгорания: | Непригодный |
| Растворимость в воде: | Бурно реагирует с водой |
| Растворимость: | Растворим в спирте, эфире |
| Давление газа: | Непригодный |
| Плотность пара: | Непригодный |
| пКа: | Непригодный |
| ПХ: | Непригодный |
Безопасность и опасность перекиси натрия
| Символы опасности: | Окисляющий, Коррозионный |
| БезопасностьОписание: | Не вдыхать пыль/дым/газ/туман/пары. Избегайте контакта с кожей/глазами. Обращайтесь и храните в среде инертного газа. При попадании в глаза немедленно промыть большим количеством воды и промыть врачу. В случае пожара используйте соответствующие средства пожаротушения. |
| Идентификационные номера ООН: | ООН1503 |
| Код ТН ВЭД: | 2829.11.00 |
| Класс опасности: | 5.1 |
| Группа упаковки: | II |
| Токсичность: | Разъедает глаза и кожу, вреден при проглатывании или вдыхании. |
Методы синтеза пероксида натрия
Синтез пероксида натрия (Na2O2) возможен несколькими методами, такими как прямое соединение, реакция с кислородом и электролиз.
Одним из методов синтеза Na2O2 является метод прямого комбинирования. Это предполагает нагревание металлического натрия с избытком кислорода в печи. Реакция экзотермическая, и важно регулировать температуру, чтобы избежать перегрева и возможного взрыва.
Другой метод включает реакцию гидроксида натрия с перекисью водорода с образованием Na2O2 и воды. Этот метод более безопасен и более контролируем, чем метод прямого комбинирования, но требует более высокой температуры и более длительного времени реакции.
Другой метод синтеза Na2O2 — электролиз. Это включает электролиз раствора гидроксида натрия с использованием подходящих анода и катода. Во время электролиза катод производит Na2O2, а анод — газообразный кислород.
Применение перекиси натрия
Пероксид натрия находит различное промышленное и лабораторное применение благодаря своим окислительным свойствам и способности выделять кислород.
Вот некоторые распространенные способы применения перекиси натрия:
- Отбеливатель: используется в качестве отбеливателя для бумажной массы, текстиля и других материалов.
- Дезодорирующий агент: используется в качестве дезодорирующего агента на предприятиях по утилизации отходов и очистке сточных вод.
- Окислитель: используется для окисления различных органических и неорганических соединений.
- Полимеризация: инициирует полимеризацию определенных мономеров. Используется в производстве пенополиуретана и других полимеров.
- Фармацевтическое применение: используется в качестве реагента при синтезе фармацевтических соединений.
- Лабораторный реагент: используется в качестве лабораторного реагента для различных аналитических и синтетических целей.
- Применение в топливных элементах: используется в качестве окислителя в топливных элементах для выработки электроэнергии.
Вопросы:
Вопрос: Какова химическая реакция между перекисью водорода и бисульфитом натрия?
Ответ: Химическая реакция между перекисью водорода и бисульфитом натрия приводит к образованию воды и сульфата натрия. Сбалансированное уравнение реакции: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
Вопрос: Где купить порошок перекиси натрия?
Ответ: Порошок пероксида натрия можно приобрести у различных поставщиков и дистрибьюторов химикатов. Важно убедиться, что поставщик имеет хорошую репутацию и соблюдает надлежащие протоколы безопасности при обращении и транспортировке опасных химикатов.
Вопрос: Можно ли превратить оксид натрия в боргидрид и перекись водорода?
Ответ: Оксид натрия не может быть получен непосредственно из боргидрида и перекиси водорода. Оксид натрия можно синтезировать реакцией металлического натрия с кислородом или нагреванием гидроксида натрия. Боргидрид и перекись водорода обычно не используются в синтезе оксида натрия.
Вопрос: Какова формула перекиси натрия?
Ответ: Формула перекиси натрия: Na2O2.
Вопрос: Какова степень окисления Na2O2?
Ответ: Степень окисления натрия в Na2O2 равна +1, а степень окисления кислорода — -1.
Вопрос: Какова степень окисления кислорода в соединении Na2O2?
Ответ: Степень окисления кислорода в соединении Na2O2 равна -1.
