Пероксид кальция (CaO2) — химическое соединение, выделяющее кислород при контакте с водой. Он обычно используется в качестве окислителя в промышленности и сельском хозяйстве, включая восстановление почв и очистку сточных вод.
| Название ИЮПАК | Диоксид кальция |
| Молекулярная формула | СаО2 |
| Количество CAS | 1305-79-9 |
| Синонимы | Супероксид кальция; Пероксид кальция диоксид; КП |
| ИнЧИ | InChI=1S/Ca.O2/c;1-2/q+2;-2 |
Свойства перекиси кальция
Формула перекиси кальция
Химическая формула пероксида кальция — CaO2, что указывает на то, что соединение содержит один атом кальция и два атома кислорода. Формула представляет собой состав соединения и полезна при определении молярной массы и других свойств вещества. Пероксид кальция обычно используется в качестве окислителя в различных отраслях промышленности и сельского хозяйства, включая восстановление почв, очистку сточных вод и производство газообразного кислорода.
Молярная масса пероксида кальция
Молярная масса пероксида кальция, представленная химической формулой CaO2, составляет 72,077 г/моль. Молярная масса — это масса одного моля вещества, которая обычно используется для преобразования массы в моли в химических реакциях. Знание молярной массы CaO2 полезно для определения того, сколько вещества необходимо для конкретной реакции.
Температура кипения перекиси кальция
CaO2 является твердым соединением и не имеет точки кипения в традиционном понимании. Вместо этого при нагревании он подвергается термическому разложению, выделяя газообразный кислород и оставляя после себя оксид кальция. Этот процесс происходит при температуре выше 150°C (302°F).
Температура плавления пероксида кальция
Точка плавления CaO2, то есть температура, при которой он переходит из твердого состояния в жидкое, составляет примерно 350°C (662°F). Такая высокая температура плавления обусловлена прочными ионными связями между атомами кальция и кислорода соединения.
Плотность пероксида кальция г/мл
Плотность CaO2 составляет 2,91 г/мл. Плотность является мерой количества массы в единице объема и полезна для определения того, сколько места занимает вещество.
Молекулярный вес пероксида кальция
Молекулярная масса CaO2 составляет 72,077 г/моль. Это значение рассчитывается путем сложения атомных весов всех атомов химической формулы CaO2.
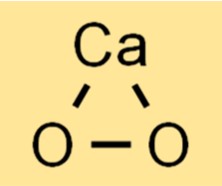
Структура пероксида кальция
CaO2 имеет кристаллическую структуру, в которой каждый ион кальция окружен шестью атомами кислорода. Атомы кислорода расположены в тетраэдрической геометрии вокруг иона кальция, причем каждый кислород образует ковалентную связь с ионом кальция. Соединение имеет белый или желтоватый цвет и нерастворимо в воде.
| Появление | белый порошок |
| Удельная плотность | 2,91 г/см³ |
| Цвет | Белый или желтоватый |
| Запах | Без запаха |
| Молярная масса | 72,077 г/моль |
| Плотность | 2,91 г/мл |
| Точка плавления | ~350°С (662°Ф) |
| Точка кипения | Разлагается при температуре выше 150°C (302°F) |
| Мигающая точка | Н/Д |
| Растворимость в воде | нерастворимый |
| Растворимость | Нерастворим в органических растворителях |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Н/Д |
Безопасность и опасности перекиси кальция
CaO2 представляет несколько потенциальных опасностей и проблем безопасности. Это окислитель, который может вызвать пожар или взрыв при контакте с органическими материалами, такими как масла или топливо. Кроме того, он может бурно реагировать с некоторыми кислотами, такими как соляная кислота. Контакт с глазами, кожей или дыхательной системой может вызвать раздражение, а проглатывание или вдыхание могут вызвать более серьезные последствия для здоровья. Важно обращаться с CaO2 осторожно и соблюдать надлежащие меры безопасности, включая ношение защитной одежды и очков и работу в хорошо проветриваемом помещении.
| Символы опасности | Окислитель, Раздражающее вещество |
| Описание безопасности | Избегайте контакта с органическими материалами. Носите защитную одежду и очки. Работайте в хорошо проветриваемом помещении. |
| Идентификационные номера ООН | ООН1457 |
| код ТН ВЭД | 2825.90.90 |
| Класс опасности | 5.1 (Окислители) |
| Группа упаковки | III |
| Токсичность | Может вызвать раздражение при контакте с глазами, кожей или дыхательной системой. Может вызвать более серьезные последствия для здоровья при проглатывании или вдыхании. |
Методы синтеза пероксида кальция
Синтезировать СаО2 можно различными методами.
Распространенный метод включает реакцию CaO с перекисью водорода в присутствии воды. Другой метод включает реакцию Ca(OH)2 с перекисью водорода . В обоих случаях результирующим продуктом являются CaO2 и вода.
Другой метод предполагает реакцию Ca(OH)2 с пероксидом натрия. При этом образуются CaO2 и гидроксид натрия.
Реакция между CaCl2 и пероксидом натрия также известна. При этом образуются CaO2 и хлорид натрия.
В лаборатории CaO2 также можно получить путем реакции металлического кальция с газообразным кислородом. Однако этот метод непрактичен для крупномасштабного производства из-за высокой стоимости металлического кальция.
Использование перекиси кальция
CaO2 имеет множество применений в нескольких отраслях. Вот некоторые из наиболее распространенных приложений:
- Сельское хозяйство: используется в качестве источника кислорода при санитарии почвы и в качестве консерванта сельскохозяйственных культур.
- Восстановление окружающей среды: используется для усиления биовосстановления загрязненной почвы и воды за счет медленного выделения кислорода.
- Пищевая промышленность: Используется в качестве пищевой добавки для улучшения качества теста и отбеливания муки.
- Химический синтез: используется в производстве различных химикатов, включая H2O2 и стеарат кальция.
- Производство полимеров: используется в качестве полимерного инициатора при производстве полиэтилена и других пластмасс.
- Очистка воды: используется в качестве источника перекиси водорода для очистки воды, включая дезинфекцию и контроль запаха.
- Горное дело: используется в качестве взрывчатого вещества при добыче полезных ископаемых.
- Нефтяная и газовая промышленность: используется в качестве источника кислорода для повышения нефтеотдачи и для удаления сульфидов и меркаптанов из потоков нефти и газа.
Вопросы:
Вопрос: Может ли перекись водорода растворять отложения кальция в организме человека?
Ответ: В некоторых случаях перекись водорода может быть эффективной для удаления отложений Ca2+, но ее следует использовать только под руководством медицинского работника.
Вопрос: Откуда берется перекись кальция?
Ответ: CaO2 был впервые открыт в начале 1900-х годов французским химиком Полем Сабатье.
Вопрос: Что такое перекись кальция?
Ответ: CaO2 представляет собой белый или желтоватый порошок, используемый в качестве источника кислорода в различных промышленных и экологических целях.
Вопрос: Является ли перекись кальция солью?
Ответ: Нет, CaO2 не является солью. Это химическое соединение, содержащее кальций, кислород и иногда другие элементы.
Вопрос: Что такое CaO2?
Ответ: CaO2 — это химическая формула пероксида кальция.
Вопрос: Что означает CaO2?
Ответ: CaO2 — это сокращение от химического соединения перекиси кальция.
