Пентагидрат тиосульфата натрия (Na2S2O3 · 5H2O) — кристаллическое соединение, легко растворяющееся в воде. Его обычно используют при обработке фотографий и в качестве медицинского противоядия при отравлении цианидами.
| Название ИЮПАК | Пентагидрат тиосульфата натрия |
| Молекулярная формула | Na2S2O3 · 5H2O |
| Количество CAS | 10102-17-7 |
| Синонимы | Пентагидрат гипосульфита натрия, Пентагидрат тиосульфата натрия, Гидрат тиосульфата натрия, 5-гидрат тиосульфата натрия |
| ИнЧи | InChI=1S/2Na.H2O3S2,5H2O/c;;1-5(2,3)4;;;;;/h;;(H2,1,2,3,4);5 1H2/q2 +1; ;;;;;/п-2 |
Свойства пентагидрата тиосульфата натрия
Формула пентагидрата тиосульфата натрия
Химическая формула пентагидрата тиосульфата натрия: Na2S2O3 · 5H2O. Он состоит из двух ионов Na+, двух ионов (S2O3)2- и пяти молекул воды. Соединение имеет белый кристаллический вид и хорошо растворяется в воде.
Молярная масса пентагидрата тиосульфата натрия
Молярная масса Na2S2O3 · 5H2O составляет 248,18 г/моль. Это сумма атомных масс натрия, серы, кислорода и водорода в соединении. Молярная масса — важный параметр в химических расчетах, особенно для определения количества вещества, необходимого для реакции.
Температура кипения пентагидрата тиосульфата натрия
Na2S2O3 · 5H2O не имеет определенной температуры кипения, так как при нагревании разлагается. Вместо этого он подвергается процессу термического разложения, в результате которого выделяются водяной пар и диоксид серы. Температура разложения Na2S2O3 · 5H2O составляет около 48°С.
Пентагидрат тиосульфата натрия. Температура плавления.
Температура плавления Na2S2O3 · 5H2O составляет 48,3°С. При этой температуре соединение претерпевает фазовый переход из твердого состояния в жидкость. Na2S2O3 · 5H2O имеет относительно низкую температуру плавления, что объясняется наличием молекул воды в его кристаллической структуре.
Пентагидрат тиосульфата натрия Плотность, г/мл
Плотность Na2S2O3 · 5H2O составляет 1,67 г/мл. Соединение имеет относительно высокую плотность по сравнению с другими солями, что обусловлено наличием в его кристаллической структуре нескольких ионов. Плотность вещества определяется как количество массы в единице объема.
Молекулярный вес пентагидрата тиосульфата натрия
Молекулярная масса Na2S2O3 · 5H2O составляет 248,18 г/моль. Это сумма атомных масс элементов, входящих в состав соединения. Молекулярная масса является важным параметром в химических расчетах, особенно для определения стехиометрии реакции.
Пентагидратная структура тиосульфата натрия
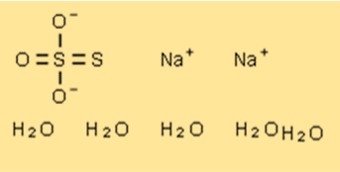
Кристаллическая структура Na2S2O3 · 5H2O состоит из катионов натрия, тиосульфат-анионов и молекул воды. Ионы натрия расположены по углам элементарной ячейки, а тиосульфат-анионы и молекулы воды расположены в слоистой структуре. Тиосульфат-анионы и молекулы воды образуют цепи, которые простираются вдоль оси c элементарной ячейки.
Растворимость пентагидрата тиосульфата натрия
Na2S2O3 · 5H2O хорошо растворим в воде. Растворимость вещества определяется как максимальное количество вещества, которое можно растворить в данном количестве растворителя при определенной температуре и давлении. Растворимость Na2S2O3 · 5H2O в воде увеличивается с температурой и используется в различных промышленных и медицинских целях.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1,67 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 248,18 г/моль |
| Плотность | 1,67 г/мл |
| Точка плавления | 48,3°С |
| Точка кипения | Разлагается при 48°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и глицерине |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 7.2 |
| рН | 6,5-9,5 (5% раствор в воде) |
Пентагидрат тиосульфата натрия Безопасность и опасности
Na2S2O3 · 5H2O обычно считается безопасным в обращении и использовании. Однако он может вызвать раздражение глаз, кожи и дыхательной системы. Проглатывание большого количества Na2S2O3 · 5H2O может вызвать расстройство желудочно-кишечного тракта. Также важно избегать контакта с окислителями и сильными кислотами, поскольку они могут бурно реагировать с этими веществами. Na2S2O3 · 5H2O не считается опасным для пожара или взрыва, но может выделять токсичные пары при нагревании до разложения. Как и в случае со всеми химическими веществами, при обращении и использовании Na2S2O3 · 5H2O следует принимать соответствующие меры предосторожности, чтобы свести к минимуму любые потенциальные риски.
| Символы опасности | Никто |
| Описание безопасности | S24/25 – Избегайте контакта с кожей и глазами. |
| Идентификационные номера ООН | Не регулируется |
| код ТН ВЭД | 2832.10.00 |
| Класс опасности | Не классифицируется как опасный по СГС. |
| Группа упаковки | Непригодный |
| Токсичность | LD50 (перорально, крыса): > 6000 мг/кг |
Методы синтеза пентагидрата тиосульфата натрия
Различные методы позволяют синтезировать Na2S2O3 · 5H2O.
Распространенный метод включает реакцию сульфита натрия с серой в щелочных условиях. Другой метод предполагает реакцию гидроксида натрия с диоксидом серы с последующим добавлением серы. При нагревании смеси образуется Na2S2O3 · 5H2O.
Для синтеза Na2S2O3 · 5H2O химики реагируют сульфид натрия с диоксидом серы, в результате чего образуется сульфит натрия. Затем окислите сульфит натрия перекисью водорода или хлором с образованием сульфата натрия. Реакция серы с сульфатом натрия протекает в щелочных условиях и полученную смесь нагревают с образованием Na2S2O3 · 5H2O.
Важно отметить, что синтез Na2S2O3 · 5H2O следует проводить с соблюдением соответствующих мер безопасности, таких как использование защитного оборудования и достаточная вентиляция. Кроме того, чистота сырья и условия реакции могут влиять на выход и чистоту конечного продукта.
Применение пентагидрата тиосульфата натрия
Na2S2O3 · 5H2O благодаря своим уникальным свойствам находит множество применений в различных отраслях промышленности. Некоторые из его распространенных применений включают в себя:
- Фотография: активно действует как фотографический фиксатор, удаляя неэкспонированный галогенид серебра с фотопленки.
- Медицинский: используется в качестве противоядия при отравлении цианидами, поскольку он может вступать в реакцию с цианидом с образованием менее токсичного тиоцианата.
- Очистка воды: используется для удаления хлора из воды, что важно в таких отраслях, как бассейны, аквариумы и очистка сточных вод.
- Аналитическая химия: используется в качестве восстановителя при титровании и в качестве комплексообразователя при определении тяжелых металлов.
- Сельское хозяйство: используется в качестве удобрения для устранения дефицита серы в растениях.
- Текстильная промышленность: Также используется в качестве отбеливателя для шерстяных и шелковых тканей.
- Добыча золота: используется при добыче золота для извлечения золота из руд путем выщелачивания.
- Другое применение: Обычно используется в производстве бумаги, красителей и в качестве лабораторного реагента.
Вопросы:
Вопрос: Сколько граммов пентагидрата тиосульфата натрия потребуется для приготовления 250,0 мл 0,1000 М?
Ответ: Для приготовления 250,0 мл 0,1000 М раствора Na2S2O3 · 5H2O потребуется 9,944 грамма Na2S2O3 · 5H2O.
Вопрос: Как разбавить пентагидрат тиосульфата натрия?
A: Na2S2O3 · 5H2O можно разбавить, растворив его в воде. Необходимое количество воды зависит от желаемой концентрации раствора.
Вопрос: Сколько именно граммов твердого пентагидрата тиосульфата натрия необходимо для приготовления?
О: Количество твердого Na2S2O3 · 5H2O, необходимое для приготовления раствора, зависит от желаемой концентрации и объема раствора. Для расчета необходимого количества твердого вещества можно использовать формулу C1V1 = C2V2, где C1 и V1 — начальная концентрация и объем соответственно, а C2 и V2 — конечная концентрация и объем соответственно.
Вопрос: Для чего используется пентагидрат тиосульфата натрия?
О: Na2S2O3 · 5H2O используется в фотографии, медицинской промышленности, водоочистке, аналитической химии, сельском хозяйстве, текстильной промышленности, добыче золота, производстве бумаги, производстве красителей и в качестве лабораторного реагента.
Вопрос: Кто продает пентагидрат тиосульфата натрия?
Ответ: Na2S2O3 · 5H2O продается различными поставщиками и дистрибьюторами химикатов как онлайн, так и оффлайн. Некоторые примеры включают Sigma-Aldrich, Fisher Scientific и VWR International.
Вопрос: Что можно использовать вместо Na2S2O3·5H2O, чтобы погасить любые реакции?
Ответ: Существуют различные химические соединения, которые можно использовать в качестве альтернативы Na2S2O3 · 5H2O для реакций гашения, в зависимости от конкретной реакции и требований. Некоторые примеры включают мочевину, гидрохлорид гидроксиламина и бисульфит натрия.
Вопрос: Что такое Na2S2O3·5H2O?
Ответ: Na2S2O3·5H2O — это химическая формула Na2S2O3·5H2O, белого кристаллического соединения, используемого в различных промышленных и лабораторных целях.
