Оксид магния (MgO) представляет собой белое порошкообразное твердое вещество, используемое в качестве строительного материала и пищевой добавки. Он также используется как антацид из-за своих основных (щелочных) свойств.
| Название ИЮПАК | Оксид магния |
| Молекулярная формула | MgO |
| Количество CAS | 1309-48-4 |
| Синонимы | Магнезия, Магнезит, Периклаз |
| ИнЧИ | ИнХИ=1S/MgO/c1-2 |
Формула оксида магния
Химическая формула оксида магния — MgO. Он представляет собой ион магния (Mg2+) и ион кислорода (O2-). Формула указывает соотношение элементов, присутствующих в соединении, и используется для записи сбалансированных химических уравнений реакций с участием оксида магния.
оксид магния Молярная масса
Молярная масса оксида магния составляет 40,304 г/моль. Он рассчитывается путем сложения атомных масс каждого элемента, присутствующего в соединении. Атомная масса магния составляет 24 305 г/моль, а атомная масса кислорода — 16 000 г/моль. Молярная масса важна при определении количества вещества, присутствующего в данном образце оксида магния.
Температура кипения оксида магния
Температура кипения оксида магния составляет 2852°С. При этой температуре давление паров твердого вещества становится равным атмосферному давлению и оно начинает кипеть. Высокая температура кипения оксида магния обусловлена его ионной природой, требующей большого количества энергии для разделения ионов в решеточной структуре.
Температура плавления оксида магния
Температура плавления оксида магния составляет 2800°С. При этой температуре твердое вещество переходит в жидкое состояние. Высокая температура плавления оксида магния также обусловлена его ионной природой и прочными связями между ионами в сетчатой структуре.
Плотность оксида магния г/мл
Плотность оксида магния составляет 3,58 г/мл. Это значение можно использовать для определения количества места, занимаемого данной массой оксида магния. Это характерное свойство соединения, которое полезно в различных приложениях.
Молекулярный вес оксида магния
Молекулярная масса оксида магния составляет 40,304 г/моль. Это сумма атомных весов каждого элемента, присутствующего в соединении. Молекулярная масса важна при определении количества вещества, присутствующего в данном образце оксида магния.
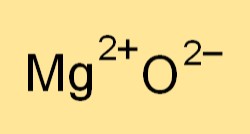
Структура оксида магния
Оксид магния имеет структуру кристаллической решетки, в которой ионы магния окружены ионами кислорода. Ионы магния и кислорода удерживаются вместе прочными ионными связями, которые способствуют высоким температурам плавления и кипения соединения. Кристаллическая структура является важным фактором, определяющим свойства оксида магния, такие как его плотность и теплопроводность.
| Появление | Белое порошкообразное твердое вещество |
| Удельный вес | 3,58 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 40,304 г/моль |
| Плотность | 3,58 г/мл |
| Точка плавления | 2800°С |
| Точка кипения | 2852°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | нерастворимый |
| Растворимость | Растворим в кислоте |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Щелочная (основная) |
Безопасность и опасность оксида магния
Оксид магния обычно считается безопасным для потребления человеком в рекомендуемых дозах и используется в качестве пищевой добавки и антацида. Однако вдыхание высоких концентраций пыли оксида магния может вызвать раздражение дыхательных путей, а длительное воздействие может привести к повреждению легких. Проглатывание большого количества оксида магния может вызвать диарею, тошноту и дискомфорт в животе. Важно хранить оксид магния в сухом, хорошо проветриваемом помещении, чтобы избежать вдыхания пыли. Избегайте контакта кожи и глаз с оксидом магния, так как это может вызвать раздражение. Как и в случае со всеми химическими веществами, при работе с оксидом магния важно соблюдать надлежащие процедуры обращения и техники безопасности, чтобы свести к минимуму риск травм.
| Символы опасности | Н/Д |
| Описание безопасности | С26-С36/37/39 |
| Идентификационные номера ООН | ООН3077, Вещества опасные для окружающей среды твердые, н.у. (оксид магния) |
| код ТН ВЭД | 2825.90.90 |
| Класс опасности | 9 |
| Группа упаковки | III |
| Токсичность | Низкая токсичность при приеме внутрь в рекомендуемых дозах, может вызвать раздражение дыхательных путей при вдыхании в высоких концентрациях. |
Методы синтеза оксида магния
Оксид магния (MgO) можно синтезировать несколькими методами, включая термическое разложение, осаждение и золь-гель процессы.
Термическое разложение, также известное как прокаливание, включает нагревание карбоната или гидроксида магния при высоких температурах с получением MgO. Этот метод широко используется при производстве огнеупорных материалов, а также при синтезе MgO высокой чистоты для фармацевтической и химической промышленности.
Осаждение — еще один метод синтеза MgO. Этот метод включает реакцию солей магния, таких как хлорид или сульфат магния, с щелочным раствором, таким как гидроксид натрия или гидроксид калия, с образованием MgO. Выпавший в осадок MgO затем можно отфильтровать, промыть и высушить с получением чистого продукта.
Золь-гель-процессы включают гидролиз и конденсацию предшественников магния, таких как алкоксиды магния, с образованием MgO. Преимущество этого метода заключается в производстве MgO с однородным размером частиц и четко определенной кристаллической структурой, что делает его полезным для применения в катализаторной, керамической и электронной промышленности.
В целом, метод синтеза MgO будет зависеть от желаемой чистоты, размера частиц и кристаллической структуры, а также предполагаемого применения продукта MgO. Независимо от метода синтеза важно тщательно контролировать условия реакции, чтобы избежать образования примесей и получить качественный MgO-продукт.
Использование оксида магния
Оксид магния (оксид магния) имеет широкий спектр применения благодаря своей химической стабильности, высокой теплопроводности и электроизоляционным свойствам. Некоторые из наиболее распространенных применений оксида магния включают в себя:
- Оксид магния (MgO) имеет широкий спектр применения благодаря своей химической стабильности, высокой теплопроводности и электроизоляционным свойствам.
- В строительной отрасли MgO используется в качестве огнестойкого материала и при производстве огнеупорных материалов.
- Фармацевтическая промышленность использует MgO в качестве пищевой добавки и антацида для нейтрализации желудочной кислоты.
- MgO служит источником магния при производстве других соединений магния, таких как гидроксид магния и карбонат магния.
- Химическая промышленность использует MgO в качестве катализатора в различных реакциях, включая производство синтетического каучука, пластмасс и смол.
- Сельскохозяйственная промышленность использует MgO в качестве добавки к почве, чтобы улучшить плодородие почвы и обеспечить необходимый магний для роста растений.
- Способность MgO адсорбировать тяжелые металлы и токсичные вещества делает его полезным для восстановления окружающей среды.
- Керамическая промышленность использует MgO в качестве сырья при производстве керамики, электроизоляторов, огнеупорных материалов и высокотемпературной изоляции.
- Электронная промышленность использует MgO в производстве электронных устройств, таких как конденсаторы и транзисторы, из-за его высокой диэлектрической проницаемости и низкого тангенса потерь.
В целом оксид магния — универсальный материал, который имеет множество применений благодаря уникальному сочетанию химических и физических свойств.
Вопросы:
Что лучше всего описывает такое соединение, как оксид магния?
Оксид магния (MgO) образует ионное соединение.
Металлический магний отдает электроны неметаллическому кислороду, создавая положительно заряженные ионы магния (Mg2+) и отрицательно заряженные ионы оксида (O2-). Эти ионы связываются ионно за счет сильного электростатического притяжения, что приводит к образованию твердой кристаллической структуры.
Ионные соединения обладают высокими температурами плавления и кипения, твердостью при комнатной температуре, хорошей электропроводностью в расплавленном или растворенном состоянии и нерастворимостью в большинстве растворителей. Эти характеристики отличают ионные соединения от молекулярных соединений, которые образуются за счет ковалентной связи и имеют более низкие температуры плавления и кипения, плохую электропроводность и растворимость во многих растворителях.
Какое ионное соединение используется в качестве строительного материала? известняковая соль оксид магния оксид железа
Соляной известняк не является ионным соединением, а оксид магния и оксид железа.
Оксид магния (MgO) и оксид железа используются в качестве строительных материалов. MgO образует противопожарные стены и перегородки и служит компонентом огнеупорных материалов, предназначенных для применения при высоких температурах. Оксид железа, также известный как гематит, в качестве пигмента придает кирпичу, бетону и керамике красновато-коричневый цвет. Гематит также действует как катализатор химических реакций и служит магнитным материалом в различных технологиях.
