Оксид лития (Li2O) представляет собой соединение лития и кислорода. Он обладает сильными ионными свойствами и широко используется в батареях благодаря своему высокому электрохимическому потенциалу.
| Название ИЮПАК | Оксид лития |
| Молекулярная формула | Ли2О |
| Количество CAS | 12142-77-7 |
| Синонимы | оксид лития(I); оксид дилития; Лития; оксолитий; УНИИ-06Т3К8П3КУ |
| ИнЧИ | InChI=1S/2Li.O |
Формула оксида лития
Формула оксида лития
Химическая формула оксида дилития — Li2O. Он представляет собой комбинацию двух атомов лития (Li) и одного атома кислорода (O). Это простое и стабильное соединение незаменимо в различных отраслях промышленности.
оксид лития Молярная масса
Молярная масса Li2O составляет примерно 29,88 г/моль. Он рассчитывается путем сложения атомных масс двух атомов лития (6,94 г/моль каждый) и одного атома кислорода (16,00 г/моль).
Температура кипения оксида лития
Оксид дилития имеет впечатляющую температуру кипения — около 2463 градусов по Цельсию (4465 градусов по Фаренгейту). Эта исключительно высокая температура кипения делает его полезным в отраслях, требующих чрезвычайной термостойкости.
Температура плавления оксида лития
Температура плавления оксида дилития составляет примерно 1450 градусов Цельсия (2642 градуса по Фаренгейту). Под воздействием этой температуры он переходит из твердого состояния в жидкое, что облегчает различные производственные процессы.
Плотность оксида лития г/мл
Оксид дилития имеет плотность примерно 2,01 г/мл. Это значение представляет собой массу соединения на единицу объема и имеет важное значение для определения его свойств и применения.
Молекулярный вес оксида лития
Молекулярная масса Li2O составляет 29,88 г/моль. Это сумма атомных весов составляющих его элементов: лития и кислорода. Это значение облегчает стехиометрические расчеты.
Структура оксида лития
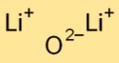
Оксид дилития имеет простую ионно-кристаллическую структуру. Он состоит из катионов лития (Li+) и оксидных анионов (O2-), удерживаемых вместе сильными электростатическими силами. Такое расположение способствует его стабильности и проводимости.
Растворимость оксида лития
Оксид дилития плохо растворяется в воде. Он реагирует с водой с образованием гидроксида лития, ограничивая его растворение. Однако он проявляет некоторую растворимость в некоторых неводных растворителях и расплавленных солях.
В заключение отметим, что оксид дилития является важным соединением с различными характеристиками и применением. Его стабильная структура, высокие температуры плавления и кипения делают его ценным в таких отраслях, как производство керамики, стекла и в качестве компонента специализированных аккумуляторов. Понимание его свойств позволяет нам использовать его потенциал для различных целей.
| Появление | Белый твердый |
| Удельный вес | 2,01 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 29,88 г/моль |
| Плотность | 2,01 г/мл |
| Точка плавления | 1450°С (2642°F) |
| Точка кипения | 2463°С (4465°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует с водой |
| Растворимость | Плохая растворимость в воде, форма гидроксида лития. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Непригодный |
| рН | Непригодный |
Обратите внимание, что некоторые свойства, такие как температура вспышки, давление пара, плотность пара, pKa и pH, неприменимы или недоступны для Li2O из-за его химической природы и поведения.
Безопасность и опасность оксида лития
Оксид дилития представляет определенные проблемы безопасности и опасности. Он сильно реагирует с водой, образуя гидроксид лития, который является едким и может вызвать раздражение кожи и глаз. Вдыхание его пыли или паров может вызвать раздражение дыхательных путей. Соединение не классифицируется как высокотоксичное, но с ним следует обращаться осторожно, чтобы избежать попадания на кожу или в глаза. При работе с оксидом дилития необходимы надлежащая вентиляция и средства индивидуальной защиты. В случае случайного проглатывания необходима немедленная медицинская помощь. Кроме того, его следует хранить вдали от несовместимых веществ, чтобы избежать потенциального риска возгорания или взрыва.
| Символы опасности | Коррозионный |
| Описание безопасности | Реагирует с водой. Вызывает раздражение кожи и глаз. Обращаться осторожно. Избегайте вдыхания пыли и паров. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2825.70.00 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | III |
| Токсичность | Не очень токсичен, но требует осторожности. Избегайте проглатывания и контакта с кожей и глазами. |
Методы синтеза оксида лития
Различные методы позволяют синтезировать оксид дилития.
Обычный подход предполагает реакцию металлического лития с кислородом или воздухом при высоких температурах. В этом процессе газообразный кислород способствует нагреванию металлического лития, что приводит к образованию оксида дилития.
Другой метод — термическое разложение солей лития, таких как карбонат или гидроксид лития , при повышенных температурах. Подвергая эти соли нагреванию, они разлагаются с образованием оксида дилития.
Кроме того, для получения оксида дилития в качестве прекурсора можно использовать гидроксид лития . Сначала его обезвоживают путем нагревания, превращая его в желаемую форму оксида.
Другой метод предполагает использование минералов или руд, содержащих литий. Химические процессы позволяют извлечь из этих природных источников соединения лития, которые, в свою очередь, подвергаются дальнейшей переработке с получением оксида дилития.
Важно отметить, что каждый метод синтеза может иметь определенные преимущества и проблемы с точки зрения стоимости, эффективности и чистоты. Ученые и инженеры учитывают эти факторы при выборе наиболее подходящего метода производства оксида дилития, отвечающего конкретным промышленным или исследовательским требованиям.
Использование оксида лития
Оксид дилития (Li2O) благодаря своим уникальным свойствам находит универсальное применение в различных отраслях промышленности. Вот некоторые ключевые варианты использования:
- Керамическая промышленность: Оксид дилития является важнейшим компонентом керамики, улучшающим ее механическую прочность и термическую стабильность. Это также снижает температуру приготовления, экономя энергию во время производственного процесса.
- Производство стекла: В стекольной промышленности оксид дилития действует как флюс, снижая температуру плавления стекла и повышая его устойчивость к химическому воздействию, в результате чего получается высококачественная стеклянная продукция.
- Технология аккумуляторов: оксид дилития служит прекурсором при производстве литий-ионных аккумуляторов. Он вносит свой вклад в катодные материалы батареи, тем самым улучшая ее емкость хранения энергии и общую производительность.
- Осушитель: сильное сродство оксида дилития к воде делает его эффективным осушителем, используемым для удаления влаги из определенных сред, например, в системах кондиционирования воздуха и газоочистки.
- Металлургия: В металлургических процессах оксид дилития способствует очистке металлов путем удаления примесей.
- Специальные очки. Производство специальных очков для различных применений, таких как оптика, электроника и научные инструменты, предполагает использование оксида дилития.
- Катализатор: оксид дилития служит катализатором в некоторых химических реакциях, способствуя превращению реагентов в желаемые продукты.
- Атомная промышленность. В атомной промышленности оксид дилития действует как замедлитель нейтронов, контролируя скорость реакций ядерного деления.
Разнообразие применений подчеркивает важность оксида дилития в развитии технологий, производства и научных исследований. Его уникальные свойства продолжают стимулировать инновации в различных отраслях промышленности, что делает его ценным соединением с широким спектром практического применения.
Вопросы:
Вопрос: Какое уравнение показывает, что оксид лития образуется в результате реакции между кислородом и литием?
А: 4Li + O2 → 2Li2O
Вопрос: Какова молярная масса оксида лития Li2O?
A: Молярная масса Li2O составляет примерно 29,88 г/моль.
Вопрос: Какова формула оксида лития?
Ответ: Формула оксида дилития — Li2O.
Вопрос: Является ли оксид ионным или ковалентным?
A: Оксид дилития является ионным.
Вопрос: Какова степень окисления лития в ионной связи?
Ответ: Степень окисления лития в ионной связи равна +1.
Вопрос: Координационное число лития в Li2O?
Ответ: Координационное число лития в Li2O равно 4.
Вопрос: Li2O ионный или ковалентный?
Ответ: Li2O является ионным.
Вопрос: Какая из следующих реакций связана с энергией решетки Li2O (ΔH°latt)?
A: Реакция: Li+(г) + O2-(г) → Li2O(т).
Вопрос: Какова молярная масса оксида лития Li2O?
A: Молярная масса Li2O составляет примерно 29,88 г/моль.
Вопрос: Что из перечисленного образуется при сжигании металлического лития (Li)? О2, LiO, H2O, Li2O?
Ответ: Li2O образуется при сгорании металлического лития (Li).
Вопрос: Сколько граммов содержится в 4,5 молях Li2O?
Ответ: В 4,5 молях Li2O содержится примерно 134,46 грамма.
