Оксид калия (K2O) представляет собой химическое соединение, состоящее из двух атомов калия и одного атома кислорода. Его широко используют в производстве удобрений из-за высокого содержания калия.
| Название ИЮПАК | Оксид калия |
| Молекулярная формула | К2О |
| Количество CAS | 12136-45-7 |
| Синонимы | Поташ, оксид дикалия, оксид калия |
| ИнЧИ | ИнЧИ=1С/2К.О |
Свойства оксида калия
Формула оксида калия
Формула оксида калия – K2O. Это означает, что каждая молекула K2O содержит два атома K и один атом O. Формула оксида калия важна в химических расчетах, таких как определение молярной массы и стехиометрии соединения в химических реакциях.
оксид калия Молярная масса
K2O имеет молярную массу 94,2 г/моль. Это означает, что в одном моле K2O содержится 94,2 грамма соединения. Молярная масса соединения важна во многих химических расчетах, например, при определении количества соединения, необходимого для реакции, или массы образца соединения.
Температура кипения оксида калия
K2O имеет высокую температуру кипения 3150 ° C (5720 ° F). Такая высокая температура кипения обусловлена прочными ионными связями между атомами калия и кислорода соединения. K2O является твердым веществом при комнатной температуре и давлении, но при очень высоких температурах он может испаряться в газ.
Температура плавления оксида калия
Температура плавления K2O составляет 740°C (1364°F). Это означает, что при температуре выше 740°C K2O расплавится и станет жидким. Температура плавления K2O относительно высока по сравнению с другими ионными соединениями, такими как хлорид натрия (801°C) и оксид магния (2852°C).
Плотность оксида калия г/мл
Плотность K2O составляет 2,32 г/см³. Эта плотность больше, чем у воды (1 г/см³), и указывает на то, что K2O является относительно плотным соединением. Высокая плотность K2O обусловлена близостью атомов калия и кислорода в структуре кристаллической решетки соединения.
Молекулярный вес оксида калия
Молекулярная масса K2O составляет 94,2 г/моль. Молекулярная масса – это сумма атомных масс всех атомов молекулы соединения. Молекулярная масса K2O важна в стехиометрических расчетах, например, при определении количества реагентов, необходимых для химической реакции.
Структура оксида калия
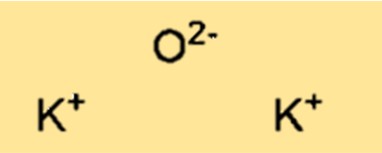
K2O имеет структуру кристаллической решетки. Структура состоит из катионов калия (K+) и оксидных анионов (O2-), расположенных в виде трехмерного повторяющегося узора. Структура кристаллической решетки K2O важна для определения физических и химических свойств соединения.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2.32 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 94,2 г/моль |
| Плотность | 2,32 г/см³ |
| Точка плавления | 740°С (1364°Ф) |
| Точка кипения | 3150 ° C (5720 ° F) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Бурно реагирует с водой |
| Растворимость | Нерастворим в органических растворителях |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасности оксида калия
K2O представляет несколько рисков и опасностей для безопасности. Он бурно реагирует с водой, выделяя большое количество тепла и образуя гидроксид калия. Эта реакция может вызвать ожоги и пожары, поэтому важно обращаться с K2O осторожно. Вдыхание или проглатывание K2O может вызвать раздражение дыхательных путей, глаз и кожи. Кроме того, высокая температура, необходимая для плавления или испарения K2O, может создать опасность ожога или пожара. Поэтому при работе с K2O следует использовать соответствующее защитное оборудование, включая перчатки, очки и респиратор, чтобы свести к минимуму эти риски.
| Символы опасности | Окисляющий, Коррозионный |
| Описание безопасности | Беречь от воды, не вдыхать, носить защитное снаряжение. |
| Идентификационные номера ООН | ООН 2257 |
| код ТН ВЭД | 2815.20 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Разъедает кожу и глаза, вдыхание может вызвать раздражение дыхательных путей. |
Методы синтеза оксида калия
Различные методы позволяют синтезировать K2O.
Распространенным методом является нагревание карбоната калия K2CO3 при высоких температурах в присутствии кислорода. В результате этого процесса образуются K2O, углекислый газ и водяной пар.
Другой метод включает реакцию металлического калия с газообразным кислородом, в результате которой образуется K2O и выделяется большое количество тепла.
Реакция между КОН и оксидом металла, например оксидом меди или оксидом железа, может привести к образованию K2O. В результате реакции образуются соответствующий гидроксид металла и K2O.
Металлический калий реагирует с водой с образованием гидроксида калия и газообразного водорода, что приводит к синтезу K2O. Дегидратация гидроксида калия приводит к образованию К2О.
В методах химического осаждения из паровой фазы в высокотемпературный реактор подается газ, содержащий калий и кислород, для синтеза K2O. Газ вступает в химическую реакцию с образованием K2O, который осаждается на поверхности подложки.
Использование оксида калия
K2O имеет множество применений в различных отраслях промышленности благодаря своим химическим и физическим свойствам. Вот некоторые распространенные варианты использования K2O:
- Производство удобрений: важный элемент производства удобрений. Это помогает растениям расти и поддерживать свое здоровье.
- Производство стекла: используется в производстве стекла для снижения температуры плавления и повышения механической прочности стекла.
- Металлургия: используется в металлургии для производства таких металлов, как титан и алюминий. Это помогает удалить примеси и улучшить общее качество конечного продукта.
- Нефтяная промышленность: используется в нефтяной промышленности в качестве катализатора при производстве метанола и других химикатов.
- Аккумуляторы: Производители аккумуляторов используют K2O в качестве электролита при производстве аккумуляторов, особенно щелочных.
- Осушитель: Это мощный осушитель. Используется для удаления влаги из материалов, таких как растворители, топливо и газы.
- Лабораторный реагент: также используется в качестве лабораторного реагента для различных химических реакций и процессов.
Вопросы:
Вопрос: Какова химическая формула оксида калия?
Ответ: Химическая формула оксида калия — K2O.
Вопрос: Какова формула оксида калия?
Ответ: Формула оксида калия — K2O.
Вопрос: Растворяется ли оксид калия в воде?
Ответ: Да, K2O растворим в воде, хотя он бурно реагирует с водой с образованием гидроксида калия.
Вопрос: Сколько граммов перманганата калия необходимо, чтобы полностью окислить 2 г толуола?
О: Количество граммов перманганата калия, необходимое для полного окисления 2 г толуола, зависит от условий реакции и стехиометрии. Для определения необходимого количества перманганата калия необходимы сбалансированное уравнение и условия реакции.
Вопрос: K2O ионный или ковалентный?
Ответ: K2O — ионное соединение, состоящее из катионов K+ и анионов O2-.
Вопрос: Что такое К2О?
Ответ: K2O — это химическая формула оксида калия, ионного соединения, имеющего множество промышленных применений.
Вопрос: Какой тип облигации представляет собой K2O?
Ответ: Связь между калием и кислородом в K2O ионная.
