Оксид аммония ((NH4)2O) представляет собой белое кристаллическое соединение, растворимое в воде и действующее как слабое основание. Он производится в результате реакции аммиака и кислорода и используется в удобрениях, чистящих средствах и в качестве огнетушителя.
| Название ИЮПАК | Оксид аммония |
| Молекулярная формула | (NH4)2O |
| Количество CAS | 12046-03-6 |
| Синонимы | Гидроксид аммония, раствор аммиака, Aqua Ammonia |
| ИнЧИ | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Свойства оксида аммония
Формула оксида аммония
Формула оксида аммония: (NH4)2O. Это соединение, состоящее из одного атома азота и четырех атомов водорода в сочетании с одним атомом кислорода.
оксид аммония Молярная масса
Молярная масса оксида аммония составляет примерно 52,07 грамма на моль. Он рассчитывается путем сложения атомных весов всех атомов, присутствующих в молекуле. Молярная масса помогает определить количество частиц, присутствующих в данном количестве вещества.
Температура кипения оксида аммония
Температура кипения (NH4)2O составляет около 90°C. Это температура, при которой давление паров жидкости равняется давлению вокруг нее, заставляя жидкость превращаться в газ. Температура кипения вещества — важное физическое свойство, которое можно использовать для идентификации и различения различных соединений.
Температура плавления оксида аммония
Температура плавления (NH4)2O составляет примерно -6°C. Это температура, при которой твердое вещество превращается в жидкость. Точку плавления вещества можно использовать для идентификации и различия различных соединений, а также для определения чистоты вещества.
Плотность оксида аммония г/мл
Плотность (NH4)2O составляет примерно 1,02 г/мл. Плотность — это количество массы в единице объема и является фундаментальным физическим свойством вещества. Плотность вещества можно использовать для идентификации и различия различных соединений, а также для определения чистоты вещества.
Молекулярный вес оксида аммония
Молекулярная масса оксида аммония составляет примерно 52,07 г/моль. Это сумма атомных весов всех атомов, присутствующих в молекуле вещества. Молекулярный вес можно использовать для расчета количества молей вещества, присутствующего в заданной массе, и он является важным физическим свойством, используемым во многих областях науки.
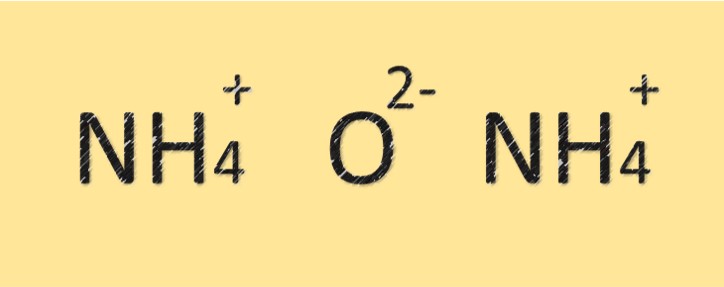
Структура оксида аммония
Оксид аммония представляет собой соединение, состоящее из атомов азота и кислорода. Он имеет молекулярную формулу (NH4)2O и состоит из двух атомов азота и одного атома кислорода. Атом азота связан с атомом кислорода ковалентной связью и также имеет положительный заряд. Соединение имеет основной или щелочной характер из-за присутствия иона аммония.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1,02 г/см³ |
| Цвет | Белый |
| Запах | Аммиак |
| Молярная масса | 52,07 г/моль |
| Плотность | 1,02 г/см³ |
| Точка плавления | -6°С |
| Точка кипения | 90°С |
| Мигающая точка | Н/Д |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | 11,6 (100 г/л, H2O, 20°С) |
Безопасность и опасность оксида аммония
(NH4)2O раздражает глаза, кожу и дыхательную систему. Вдыхание его паров может вызвать кашель, одышку и раздражение легких. Контакт с кожей может вызвать зуд и покраснение. С составом следует обращаться осторожно и использовать защитные меры, такие как перчатки и средства защиты глаз. В случае воздействия пораженные участки следует промыть водой и обратиться за медицинской помощью, если симптомы не исчезнут. Он также легко воспламеняется и его следует хранить вдали от источников возгорания.
| Символы опасности | Раздражающий |
| Описание безопасности | С26-С36/37/39 |
| Идентификационные номера ООН | ООН2672 |
| код ТН ВЭД | 2841.90.90 |
| Класс опасности | 8 |
| Группа упаковки | III |
| Токсичность | Раздражает глаза, кожу и дыхательную систему. |
Методы синтеза оксида аммония
(NH4)2O можно синтезировать несколькими методами, включая термическое разложение нитрата аммония и реакцию между газообразным аммиаком и газообразным кислородом.
Один метод включает термическое разложение нитрата аммония, который является обычным удобрением. В результате реакции образуются аммиак и диоксид азота, которые затем окисляются до диоксида азота и оксида азота. Оксид азота реагирует с большим количеством газообразного аммиака с образованием (NH4)2O.
Другой метод включает пропускание газообразного аммиака через нагретый катализатор, в результате чего атомы азота и кислорода объединяются и образуют (NH4)2O. Оба этих метода дают (NH4)2O в виде белого кристаллического твердого вещества, которое можно очистить перекристаллизацией.
Использование оксида аммония
Промышленность использует (NH4)2O для различных целей из-за высокого содержания аммония и сильных щелочных свойств. В качестве удобрения он является источником азота для растений. Чистящие средства используют его для растворения жира и грязи. В металлургической промышленности его используют как восстановитель оксидов металлов, особенно при производстве алюминия. В качестве хладагента он используется в промышленных системах охлаждения и как источник азота при производстве азотной кислоты. В лаборатории химики используют его как источник аммиака для химических реакций. Универсальность (NH4)2O делает его ценным химическим веществом, имеющим множество применений во всех отраслях.
