Нитрат никеля (Ni(NO₃)₂) — химическое соединение, содержащее ионы никеля и нитрата. Он растворим в воде и часто используется в катализаторах, гальванических покрытиях и в качестве предшественника других соединений никеля.
| Название ИЮПАК | Никель динитрат |
| Молекулярная формула | Ni(NO₃)₂ |
| Количество CAS | 13138-45-9 |
| Синонимы | Нитрат никеля (II), нитрат никеля, динитроникель, бис(нитрат никеля) |
| ИнЧИ | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
Свойства нитрата никеля
Формула нитрата никеля
Химическая формула динитрата никеля: Ni(NO₃)₂. Он представляет собой соединение, состоящее из катионов никеля (Ni) и нитрат-анионов (NO₃). Индекс «2» в формуле указывает на то, что на каждый катион Ni+2 приходится два иона NO3-.
Нитрат никеля Молярная масса
Молярную массу динитрата никеля можно рассчитать путем сложения атомных масс составляющих его элементов. Никель (Ni) имеет молярную массу примерно 58,69 г/моль, а нитрат (NO₃) имеет молярную массу примерно 62,00 г/моль. Сложив их вместе, молярная масса динитрата никеля составит примерно 182,69 г/моль.
Температура кипения нитрата никеля
Точка кипения динитрата никеля относится к температуре, при которой он переходит из жидкого состояния в газообразное. Температура кипения динитрата никеля составляет примерно 136,7 градусов Цельсия (278,06 градусов по Фаренгейту). Однако важно отметить, что это значение может незначительно меняться в зависимости от чистоты соединения.
Температура плавления нитрата никеля
Температура плавления динитрата никеля — это температура, при которой он переходит из твердого состояния в жидкое. Температура плавления динитрата никеля составляет примерно 56,7 градусов Цельсия (134,06 градусов по Фаренгейту). Как и температура кипения, температура плавления может зависеть от чистоты соединения.
Плотность нитрата никеля г/мл
Плотность динитрата никеля является мерой его массы в единице объема. Динитрат никеля имеет плотность примерно 1,68 г/мл. Это значение указывает на то, что он плотнее воды, плотность которой составляет 1 г/мл.
Нитрат никеля Молекулярный вес
Молекулярная масса динитрата никеля представляет собой сумму атомных масс всех атомов, присутствующих в его химической формуле. Как упоминалось ранее, молекулярная масса динитрата никеля составляет примерно 182,69 г/моль.
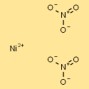
Структура нитрата никеля
Структуру динитрата никеля можно представить как катионы никеля (Ni²⁺), окруженные двумя нитрат-анионами (NO₃⁻) на катион. Ионы нитрата образуют скоординированные связи с катионами никеля, образуя стабильное ионное соединение.
Растворимость нитрата никеля
Динитрат никеля хорошо растворим в воде и образует прозрачный зеленовато-синий раствор. Его растворимость в воде является важным свойством, поскольку позволяет легко использовать его в различных областях, таких как катализаторы, гальваника и производство других соединений никеля.
| Появление | Зеленовато-голубое твердое вещество |
| Удельный вес | 1,68 г/мл |
| Цвет | зеленовато-синий |
| Запах | Без запаха |
| Молярная масса | 182,69 г/моль |
| Плотность | 1,68 г/мл |
| Точка плавления | 56,7°С |
| Точка кипения | 136,7°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и органических растворителях, таких как этанол. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нейтральный (около 7) |
Обратите внимание, что некоторые свойства могут быть недоступны или неактуальны для диитрата никеля.
Безопасность и опасность нитрата никеля
Динитрат никеля представляет некоторую угрозу безопасности, поэтому при обращении с ним следует соблюдать осторожность. Прямой контакт с составом может вызвать раздражение кожи и глаз. Вдыхание его пыли или паров может вызвать раздражение дыхательных путей. При работе с динитратом никеля важно носить соответствующие защитные средства, такие как перчатки и защитные очки. Избегайте приема внутрь, так как это может быть вредно для здоровья. В случае случайного воздействия немедленно обратитесь за медицинской помощью. Кроме того, правильное хранение в хорошо вентилируемом помещении, вдали от несовместимых веществ, имеет решающее значение для минимизации потенциальных рисков и обеспечения безопасного обращения.
| Символы опасности | Коррозионное, Раздражающее, Опасно для здоровья |
| Описание безопасности | Вызывает раздражение кожи и глаз. Вреден при вдыхании или проглатывании. Обращаться осторожно. Избегайте прямого контакта. Используйте защитное снаряжение. |
| Идентификационные номера ООН | ООН2724 |
| код ТН ВЭД | 2834.2990 |
| Класс опасности | 5.1 (Окисляющие вещества) |
| Группа упаковки | II |
| Токсичность | Умеренно токсичный |
Методы синтеза нитрата никеля
Существует несколько методов синтеза динитрата никеля. Распространенный метод включает реакцию оксида никеля (NiO) или гидроксида никеля (Ni(OH)₂) с азотной кислотой (HNO₃). Во время этого процесса оксид никеля или гидроксид никеля растворяются в азотной кислоте, что приводит к образованию динитрата никеля и воды в качестве побочных продуктов.
Реакция может принять следующее представление:
- С оксидом никеля: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O.
- С гидроксидом никеля: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O.
Другой подход включает реакцию между металлическим никелем и концентрированной азотной кислотой, в результате которой в качестве побочного продукта образуется динитрат никеля и газообразный диоксид азота (NO₂):
- С металлическим никелем: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂.
Важно проводить эти реакции в хорошо контролируемых условиях, поскольку азотная кислота является сильным окислителем и может быть опасной. Обеспечьте безопасный и успешный результат в процессе синтеза, активно применяя соответствующие меры безопасности и оборудование. Кроме того, выбор реагентов и условий реакции может варьироваться в зависимости от конкретного применения и желаемых свойств продукта динитрата никеля.
Использование нитрата никеля
Динитрат никеля благодаря своим уникальным свойствам находит множество применений в различных отраслях промышленности. Вот некоторые из его основных применений:
- Гальваническое покрытие: динитрат никеля позволяет наносить тонкий слой никеля на различные металлы, улучшая их коррозионную стойкость и внешний вид в процессе гальваники.
- Катализатор: он играет решающую роль в качестве катализатора в химических реакциях, способствуя превращению реагентов в желаемые продукты, особенно в органическом синтезе.
- Керамика. В керамической промышленности динитрат никеля используется для придания специфической окраски и улучшения характеристик керамических материалов.
- Стекольная промышленность. Производители стекольной промышленности используют динитрат никеля для производства цветного стекла с желаемыми оптическими свойствами.
- Производство аккумуляторов. Производители используют динитрат никеля при производстве аккумуляторов на основе никеля, в том числе никель-металлогидридных (NiMH) аккумуляторов.
- Топливные элементы. Динитрат никеля выступает в качестве прекурсора при производстве электродов из оксида никеля для твердооксидных топливных элементов (ТОТЭ).
- Пиротехника. В пиротехнике динитрат никеля служит окислителем, создавая зеленое пламя в фейерверках.
- Химические реагенты: он действует как реагент в различных химических реакциях, особенно с участием комплексов никеля.
- Удобрения. В сельском хозяйстве динитрат никеля иногда используется в качестве источника никеля в удобрениях для устранения дефицита никеля в некоторых культурах.
Разнообразное применение динитрата никеля в различных отраслях промышленности подчеркивает его важность как универсального соединения с широким спектром практического применения.
Вопросы:
Вопрос: Что выпадает в осадок при смешивании растворов фосфата аммония и нитрата никеля(ii)?
А: Выпадает фосфат никеля(II).
Вопрос: Какова молярность раствора, содержащего 5,8 грамма нитрата никеля в 500 мл?
A: Молярность составляет 0,2 М.
Вопрос: Какие длины волн поглощает нитрат никеля?
Ответ: Динитрат никеля поглощает волны ультрафиолетовой и видимой областей.
Вопрос: Растворим ли нитрат никеля II?
Ответ: Да, динитрат никеля(II) растворим в воде.
Вопрос: Какова формула нитрата никеля II?
A: Формула Ni(NO₃)₂.
Вопрос: Какого цвета нитрат никеля II?
A: Цвет динитрата никеля(II) зеленовато-синий.
Вопрос: Сколько атомов азота содержится в химической формуле Ni(NO₃)₂?
Ответ: Есть четыре атома азота.
Вопрос: Растворим ли Ni(NO₃)₂ в воде?
О: Да, Ni(NO₃)₂ растворим в воде.
Вопрос: Какие из соединений C4H10, BaCl2, Ni(NO₃)2, SF6 должны существовать в виде формульных единиц?
Ответ: C4H10 (бутан) и SF6 (гексафторид серы) должны существовать в виде формульных единиц. BaCl2 и Ni(NO₃)₂ являются ионными соединениями.
