Нитрат кальция – химическое соединение формулы Ca(NO3)2. Это бесцветное твердое вещество без запаха, хорошо растворимое в воде. Нитрат кальция обычно используется в качестве удобрения и при очистке сточных вод. Он также используется при производстве бетона, в качестве компонента взрывчатых веществ и при производстве различных других химикатов.
| Название ИЮПАК | динитрат кальция |
| Молекулярная формула | Са(NO3)2 |
| Количество CAS | 10124-37-5 |
| Синонимы | Тетрагидрат нитрата кальция, кальциевая соль азотной кислоты, нитрокальцит, норвежская селитра, известковая селитра, норвежская селитра. |
| ИнЧИ | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Формула нитрата кальция
Формула нитрата кальция: Ca(NO3)2. Это означает, что каждая единица нитрата кальция содержит один ион кальция (Ca²⁺) и два иона нитрата (NO3⁻). Формула нитрата кальция часто используется для определения молярной массы и других свойств соединения.
нитрат кальция Молярная масса
Нитрат кальция имеет молярную массу 164,088 г/моль. Это соль, состоящая из ионов Ca+2 и NO3-, с формулой Ca(NO3)2. Молярная масса соединения — это масса в граммах одного моля соединения формулы, равная его весу. В случае Ca(NO3)2 формульный вес представляет собой сумму атомных весов всех атомов соединения.
Температура кипения нитрата кальция
Ca(NO3)2 имеет относительно высокую температуру кипения — 132 градуса Цельсия. Это означает, что для превращения твердого соединения в газ требуется значительное количество энергии. Высокая температура кипения Ca(NO3)2 обусловлена его ионной природой, что приводит к сильным электростатическим взаимодействиям между ионами Ca+2 и NO3-.
Температура плавления нитрата кальция
Температура плавления Ca(NO3)2 составляет 561 градус Цельсия. Это относительно много для соли и еще раз отражает сильные ионные взаимодействия между ионами Ca+2 и NO3-. Температура плавления Ca(NO3)2 делает его полезным соединением для применения при высоких температурах, например, при производстве удобрений или взрывчатых веществ.
Плотность нитрата кальция г/мл
Плотность Ca(NO3)2 варьируется в зависимости от его формы. Например, плотность безводного Ca(NO3)2 составляет примерно 2,5 г/см³, а плотность тетрагидрата (Ca(NO3)2,4H2O) — примерно 1,82 г/см³. Эти значения делают Ca(NO3)2 относительно плотным соединением по сравнению со многими другими солями.
Нитрат кальция Молекулярный вес
Молекулярная масса Ca(NO3)2 составляет 164,088 г/моль. Эта величина представляет собой сумму атомных весов всех атомов соединения, в которое входят два атома азота, шесть атомов кислорода и один атом кальция.
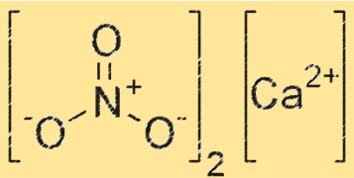
Структура нитрата кальция
Ca(NO3)2 имеет ионную структуру: ион кальция (Ca²⁺) окружен шестью атомами кислорода в октаэдрическом расположении. Ион NO3- также присутствует в кристаллической решетке, причем каждый атом кислорода иона NO3- образует координационную связь с ионом Ca+2. Структура Ca(NO3)2 аналогична структуре других ионных соединений, например хлорида натрия.
| Появление | Белые кристаллы или порошок |
| Удельный вес | 2,5 (безводный); 1,82 (тетрагидрат) |
| Цвет | Бесцветный (безводный); Белый (тетрагидрат) |
| Запах | Без запаха |
| Молярная масса | 164 088 г/моль |
| Плотность | 2,5 г/см³ (безводный); 1,82 г/см³ (тетрагидрат) |
| Точка плавления | 561°С (безводный); 45°С (тетрагидрат) |
| Точка кипения | 132°C (разлагается) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 121,2 г/100 мл (0°С); 126,7 г/100 мл (20°С); 179,6 г/100 мл (100°С) |
| Растворимость | Растворим в воде, этаноле, метаноле. |
| Давление газа | Незначительный (безводный) |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | 4,5-7,5 (10% раствор) |
Безопасность и вред нитрата кальция
Нитрат кальция (Ca(NO3)2) может представлять ряд опасностей при неправильном обращении. Это сильный окислитель, который может вызвать пожар или взрыв при контакте с горючими материалами. Соединение также может вызвать раздражение кожи и глаз при контакте, а вдыхание пыли может вызвать раздражение дыхательных путей. Ca(NO3)2 следует хранить в сухом прохладном месте вдали от источников тепла и не смешивать с другими химикатами без соответствующих мер предосторожности. При работе с Ca(NO3)2 следует надевать средства индивидуальной защиты, такие как перчатки и средства защиты глаз, чтобы избежать контакта с кожей или глазами. В случае случайного проглатывания следует немедленно обратиться за медицинской помощью.
| Символы опасности | Окислитель (GHS05), Раздражающее вещество (GHS07) |
| Описание безопасности | S22: Не вдыхать пыль/дым/газ/туман/пары/аэрозоли. S26: При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. S36/37/39: Носить соответствующую защитную одежду, перчатки и средства защиты глаз/лица. |
| Идентификаторы сети | UN1454 (Нитрат кальция безводный), UN1455 (Тетрагидрат нитрата кальция) |
| код ТН ВЭД | 283429 |
| Класс опасности | 5.1 (Окислители) |
| Группа упаковки | III |
| Токсичность | Перорально (LD50): 3420 мг/кг (крыса); Дермально (LD50): > 5000 мг/кг (кролик); Вдыхание (LC50): >4,8 мг/л/4 часа (крыса) |
Методы синтеза нитрата кальция
Существуют различные методы синтеза Ca(NO3)2 в зависимости от конкретного применения и желаемой чистоты.
Распространенным методом является реакция карбоната кальция с азотной кислотой с образованием Ca(NO3)2 и диоксида углерода:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Другой метод — взаимодействие гидроксида кальция с азотной кислотой :
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Реакция азотной кислоты с оксидом кальция дает Ca(NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
Полученный Ca(NO3)2 можно дополнительно очистить перекристаллизацией или добавлением небольшого количества серной кислоты для удаления примесей, таких как железо и алюминий.
Производители могут производить Ca(NO3)2 путем взаимодействия металлического кальция с азотной кислотой или путем взаимодействия гидроксида кальция с нитратом аммония. Однако они используют эти методы реже из-за более высокой стоимости или проблем безопасности, связанных с химически активными металлами или нитратом аммония.
Использование нитрата кальция
- Используется в качестве удобрения в сельском хозяйстве для обеспечения растений кальцием и азотом для роста.
- Используется в качестве компонента в нескольких типах бетона и цемента для повышения их прочности и долговечности.
- Используется в качестве добавки при производстве химикатов для очистки сточных вод, помогающих удалить из воды соединения фосфора и азота.
- Используется в производстве некоторых видов взрывчатых веществ и фейерверков благодаря своим окислительным свойствам.
- Используется в качестве источника кальция и азота при производстве различных химикатов, таких как нейлон и другие синтетические волокна.
- Используется в качестве ингибитора коррозии таких металлов, как алюминий и сталь, в промышленности.
- Используется при консервировании мяса и в качестве пищевой добавки для улучшения качества некоторых пищевых продуктов.
- Используется при производстве дымовых шашек и сигнальных ракет военного и гражданского назначения.
- Используется при производстве некоторых удобрений. Также используется в сочетании с другими соединениями для обеспечения сбалансированного снабжения сельскохозяйственных культур питательными веществами.
- Используется в качестве компонента некоторых специальных аквариумных удобрений для обеспечения водных растений необходимыми питательными веществами.
Вопросы:
Вопрос: Как называется Ca(NO3)2?
A: Название Ca(NO3)2 — нитрат кальция.
Вопрос: Растворим ли Ca(NO3)2 в воде?
Ответ: Да, Ca(NO3)2 хорошо растворим в воде. При комнатной температуре в 100 граммах воды растворяется до 121 грамма нитрата кальция.
Вопрос: Где купить нитрат кальция?
Ответ: Ca(NO3)2 можно приобрести у различных поставщиков химикатов, в Интернете и в магазинах. Наиболее распространенными местами приобретения Ca(NO3)2 являются компании, занимающиеся научным снабжением, магазины сельскохозяйственных товаров, а также магазины товаров для дома и сада. Важно убедиться, что поставщик пользуется хорошей репутацией, а продукция высокого качества и подходит для предполагаемого применения.
