Нитрат бария (Ba(NO3)2) представляет собой белое твердое вещество. Он растворяется в воде и образует ионы бария и нитрата. Он может взорваться при нагревании или смешивании с топливом.
| Название ИЮПАК | динитрат бария |
| Молекулярная формула | Ба(NO3)2 |
| Количество CAS | 10022-31-8 |
| Синонимы | Нитрат бария, динитрат бария, динитрат бария, CQ9625000, (нитроокси) барионитрат |
| ИнЧИ | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Свойства нитрата бария
Формула нитрата бария
Молекулярная формула нитрата бария Ba(NO3)2. Он показывает, что молекула нитрата бария состоит из одного атома бария и двух молекул нитрата. Ион нитрата имеет заряд -1, а ион бария — +2, поэтому они объединяются в соотношении 1:2, образуя нейтральное соединение.
Нитрат бария Молярная масса
Молярная масса Ba(NO3)2 составляет 261,337 г/моль. Это масса одного моля молекул Ba(NO3)2. Для его расчета необходимо сложить атомные массы всех атомов в формуле:
Молярная масса Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Температура кипения нитрата бария
Температура кипения Ba(NO3)2 составляет 83°С. Это температура, при которой Ba(NO3)2 переходит из жидкого состояния в газообразное. Однако Ba(NO3)2 разлагается, не достигнув точки кипения, поэтому его невозможно кипятить, не расщепив на другие вещества.
Нитрат бария Температура плавления
Температура плавления Ba(NO3)2 составляет 592°С. Это температура, при которой Ba(NO3)2 переходит из твердого состояния в жидкое. Ba(NO3)2 представляет собой белое кристаллическое твердое вещество при комнатной температуре и давлении, но плавится при нагревании выше температуры плавления.
Плотность нитрата бария г/мл
Плотность Ba(NO3)2 составляет 3,23 г/мл. Это масса единицы объема Ba(NO3)2. Для его расчета необходимо массу образца Ba(NO3)2 разделить на его объем:
Плотность Ba(NO3)2 = Масса/Объем
Например, если у нас есть образец Ba(NO3)2 массой 10 г и его объем 3,1 мл, то его плотность равна:
Плотность Ba(NO3)2 = 10/3,1 = 3,23 г/мл.
Нитрат бария Молекулярный вес
Молекулярная масса Ba(NO3)2 равна его молярной массе, которая составляет 261,337 г/моль. Это масса одного моля молекул Ba(NO3)2. Иногда термин «молекулярная масса» используется как синоним молярной массы, но это не совсем то же самое. Молекулярная масса относится к средней массе молекулы вещества, а молярная масса относится к массе моля вещества.
Структура нитрата бария
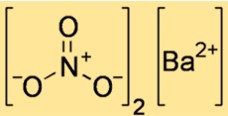
Структура Ba(NO3)2 показывает, как атомы и ионы располагаются в пространстве. Ba(NO3)2 — ионное соединение, то есть оно состоит из положительно заряженных ионов бария и отрицательно заряженных ионов нитрата, удерживаемых вместе электростатическими силами. Структуру Ba(NO3)2 можно представить элементарной ячейкой — наименьшей повторяющейся единицей, показывающей расположение ионов в кристаллической решетке.
Элементарная ячейка Ba(NO3)2 имеет форму куба с ионом бария в каждом углу и ионом нитрата в центре каждой грани. Координационное число каждого иона равно шести, что означает, что каждый ион окружен шестью противоположно заряженными ионами. Длина каждого края элементарной ячейки составляет 0,65 нм.
Растворимость нитрата бария
Растворимость Ba(NO3)2 – это количество Ba(NO3)2, которое может раствориться в заданном количестве растворителя, обычно воды. Растворимость зависит от нескольких факторов, таких как температура, давление и присутствие других веществ в растворе.
При 20°С и атмосферном давлении растворимость Ba(NO3)2 в воде составляет около 34 г на 100 мл. Это означает, что в этих условиях в 100 мл воды можно растворить 34 г Ba(NO3)2. Растворимость увеличивается с повышением температуры и снижается с повышением давления.
Ba(NO3)2 также растворим в других растворителях, таких как этанол, ацетон и метанол, но менее растворим, чем в воде.
| Появление | Белый твердый |
| Удельная плотность | 3.23 |
| Цвет | Бесцветный, серебристый или серый |
| Запах | Без запаха |
| Молярная масса | 261 337 г/моль |
| Плотность | 3,23 г/мл |
| Точка плавления | 592°С |
| Точка кипения | 83°С |
| Мигающая точка | Не воспламеняется |
| Растворимость в воде | 34 г на 100 мл при 20°C |
| Растворимость | Растворим в этаноле, ацетоне и метаноле; нерастворим в эфире и хлороформе |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Нет в наличии |
Безопасность и опасность нитрата бария
Ba(NO3)2 – токсичное и окисляющее вещество. Это может причинить вам вред, если вы проглотите его или вдохнете. Это может вызвать раздражение глаз, кожи и дыхательной системы. Ba(NO3)2 также может вызывать мышечные спазмы, проблемы с сердцем и смерть. При работе с Ba(NO3)2 следует избегать контакта и носить защитное снаряжение. Также следует беречь его от источников тепла, искр, пламени и горючих материалов. Если вы подверглись воздействию Ba(NO3)2, вам следует промыть глаза и кожу водой и обратиться за медицинской помощью. Вы также можете принимать сульфатные соли, чтобы снизить токсичность бария.
| Символы опасности | O (окислитель), Xn (вредный) |
| Описание безопасности | S13: Держите подальше от продуктов питания и напитков, в том числе предназначенных для животных. S17: Хранить вдали от горючих материалов. S22: Не дышите пылью. S26: При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. S36/37/39: Носить соответствующую защитную одежду, перчатки и средства защиты глаз/лица. |
| Идентификационные номера ООН | ООН1446 |
| код ТН ВЭД | 2834 29 10 |
| Класс опасности | 5.1 (Окисляющие материалы) |
| Группа упаковки | III |
| Токсичность | LD50 (перорально, крыса) = 355 мг/кг; LC50 (ингаляция, крыса) = 0,15 мг/л/4 часа |
Методы синтеза нитрата бария
Для создания Ba(NO3)2, представляющего собой белое твердое вещество, можно использовать разные методы.
Один из методов включает реакцию карбоната бария с азотной кислотой . При этом образуется Ba(NO3)2 и углекислый газ. Отфильтруйте раствор Ba(NO3)2, чтобы удалить примеси железа, затем выпарите его до получения твердых кристаллов.
Другой метод — взаимодействие сульфида бария с азотной кислотой . При этом образуются Ba(NO3)2 и сероводород. Для очистки и кристаллизации раствора Ba(NO3)2 мы следуем тому же процессу, что и раньше.
Третий метод включает растворение металлического бария или оксида бария в азотной кислоте . При этом образуется Ba(NO3)2 и водород или вода. Затем раствор, содержащий Ba(NO3)2, концентрируют и кристаллизуют.
Четвертый метод заключается в использовании синтеза расплавленной соли. Это включает нагревание смеси Ba(NO3)2 и неорганического нарывника, такого как хлорид аммония, бикарбонат натрия или нитрит натрия. Нарывник разрушается и создает поры в кристаллах Ba(NO3)2. Это делает их более надежными в качестве пиротехнических окислителей.
Вот некоторые методы синтеза Ba(NO3)2. Все они используют азотную кислоту в качестве общего реагента и производят в качестве продукта Ba(NO3)2.
Использование нитрата бария
Некоторые из применений Ba(NO3)2:
- Соединения оксида бария — используются при производстве материалов, содержащих оксид бария, таких как керамика, стекло и электронно-лучевые трубки.
- Зеленое пламя — используется в зеленых светофорах и фейерверках, поскольку горит зеленым пламенем из-за выделения ионов бария.
- Родентицид – используется в качестве родентицида для уничтожения крыс и мышей, поскольку он токсичен для них.
- Окислитель. Используется в детонаторах и взрывчатых веществах. Это мощный окислитель, который может усиливать горение других веществ.
- Капсюль — используется в капсюлях и трассирующих пулях, поскольку обеспечивает воспламенение и видимость боеприпаса.
- Пигмент – используется при изготовлении красок и пигментов, поскольку может придавать им белый или зеленый цвет.
- Окислитель – используется в качестве окислителя в различных химических реакциях, таких как синтез пероксида бария и гидроксида бария.
- Взрывчатые вещества – используются при производстве взрывчатых веществ, таких как баратол, который представляет собой смесь Ba(NO3)2, тротила и связующего вещества.
Вопросы:
Вопрос: Растворим ли нитрат бария?
Ответ: Ba(NO3)2 растворим в воде и некоторых других растворителях, таких как этанол, ацетон и метанол.
Вопрос: Полезен ли нитрат бария для бетона?
Ответ: Ba(NO3)2 бесполезен для бетона, так как может вызвать коррозию стальной арматуры и растрескивание бетона.
Вопрос: Образуется ли осадок, если соединить растворы сульфата калия и нитрата бария?
Ответ: Да, при объединении растворов сульфата калия (K2SO4) и нитрата бария (Ba(NO3)2) образуется осадок сульфата бария (BaSO4).
Вопрос: Нитрат бария имеет формулу Ba(NO3)2. Какое утверждение верно о нитрате бария?
Ответ: Одно из возможных утверждений: Ba(NO3)2 представляет собой ионное соединение, состоящее из одного иона бария и двух ионов нитрата.
Вопрос: Летуч ли нитрат бария?
О: Нет, Ba(NO3)2 не летуч, так как имеет высокую температуру плавления и разлагается до кипения.
Вопрос: Является ли нитрат бария нейтральным?
О: Нет, Ba(NO3)2 не является нейтральным веществом, поскольку это кислая соль, которая может снизить pH раствора.
Вопрос: Что образуется в реакции замещения Ba(NO3)2 и Na2SO4?
Ответ: NaNO3 и BaSO4 образуются в ходе реакции замещения Ba(NO3)2 и Na2SO4.
Вопрос: Растворим ли Ba(NO3)2 в воде?
Ответ: Да, Ba(NO3)2 растворим в воде, так как при его растворении образуются ионы бария и ионы нитрата.
Вопрос: Каково чистое ионное уравнение реакции MgSO4 с Ba(NO3)2?
A: Итоговое ионное уравнение реакции MgSO4 с Ba(NO3)2:
Ba2+ + SO42- → BaSO4
Вопрос: Сколько молей в 432 г Ba(NO3)2?
A: Число молей в 432 г Ba(NO3)2 равно:
n = м/М, n = 432/261 337, n = 1653 моль
Вопрос: Растворим ли Ba(NO3)2?
Ответ: Да, Ba(NO3)2 растворим, поскольку при его растворении образуются ионы бария и ионы нитрата.
