Нитрат аммония (NH4NO3) – химическое соединение. Его можно использовать в качестве удобрения или взрывчатого вещества. Он хорошо растворим в воде и гигроскопичен.
| Название ИЮПАК | Нитрат аммония |
| Молекулярная формула | NH4NO3 |
| Количество CAS | 6484-52-2 |
| Синонимы | Аммониевая соль азотной кислоты, Нитрат аммония (АН), Нитрат аммония, Нитрам, Нитрамон |
| ИнЧИ | ИнХI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Свойства аммиачной селитры
Формула нитрата аммония
Нитрат аммония – химическое соединение с формулой NH4NO3. Он состоит из двух ионов: аммония (NH4+) и нитрата (NO3-), которые удерживаются вместе ионной связью 2 . Это белый кристаллический порошок, легко растворимый в воде.
нитрат аммония Молярная масса
Молярная масса NH4NO3 составляет 80,043 г/моль. Его можно рассчитать, сложив молярные массы составляющих его элементов: азота, водорода и кислорода. Молярная масса азота составляет 14,0067 г/моль, молярная масса водорода 1,00784 г/моль, молярная масса кислорода 15,9999 г/моль.
Молярная масса NH4NO3 = 2 х молярная масса азота + 4 х молярная масса водорода + 3 х молярная масса кислорода
Молярная масса NH4NO3 = 28,0134 г/моль + 4,03136 г/моль + 47,9997 г/моль
Молярная масса NH4NO3 = 80,043 г/моль.
Температура кипения нитрата аммония
NH4NO3 не имеет определенной температуры кипения. Он разлагается при высоких температурах с выделением таких газов, как азот, кислород и водяной пар. Температура разложения NH4NO3 варьируется в зависимости от чистоты, влажности и наличия примесей или добавок. Температура разложения чистого NH4NO3 составляет примерно 210°С или 483 К.
Температура плавления нитрата аммония
Температура плавления NH4NO3 составляет 169,6 °C или 442,8 К. При этой температуре он претерпевает фазовый переход от ромбоэдрической кристаллической структуры к кубической кристаллической структуре. Он также может образовывать эвтектическую смесь с водой, температура плавления которой составляет около -16 °C или 257 К.
Плотность аммиачной селитры г/мл
Плотность NH4NO3 составляет 1,725 г/мл или 1725 кг/м3 при температуре и давлении окружающей среды. Он плотнее воды, плотность которой в тех же условиях составляет около 1 г/мл или 1000 кг/м3. Плотность NH4NO3 уменьшается с повышением температуры из-за теплового расширения.
Нитрат аммония Молекулярный вес
Молекулярная масса NH4NO3 равна его молярной массе, которая составляет 80,043 г/моль. Молекулярная масса — это масса одного моля или 6,022 х 10^(23) молекул NH4NO3. Молекулярный вес также может быть выражен в единицах атомной массы (а.е.м.), определяемых как одна двенадцатая массы атома углерода-12.
Молекулярная масса NH4NO3 в а.е.м. составляет 80,043 x (1/12) x (10^(23)) а.е.м.
Молекулярная масса NH4NO3 в а.е.м. составляет примерно 6,669 x 10^(23) а.е.м.
Структура аммиачной селитры
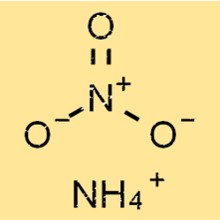
NH4NO3 имеет простую ионную структуру, состоящую из положительно заряженных ионов аммония и отрицательно заряженных ионов нитрата. Ион аммония имеет тетраэдрическую форму с четырьмя атомами водорода, связанными с центральным атомом азота ковалентными связями.
NH4+
ЧАС
|
ХНХ
|
ЧАС
Нитрат-ион имеет тригональную плоскую форму с тремя атомами кислорода, связанными с центральным атомом азота ковалентными связями, одна из которых является двойной связью.
№ 3-
Ой
||
Ой
Растворимость нитрата аммония
Растворимость NH4NO3 относится к количеству этого соединения, которое растворяется в воде или других растворителях. NH4NO3 хорошо растворим в воде, и его растворимость увеличивается с температурой. Например, при 20°С в 100 мл воды растворяется 150 г NH4NO3, а при 100°С в том же количестве воды растворяется 1024 г. NH4NO3 также растворяется в метаноле, этаноле и ацетоне, но не растворяется в диэтиловом эфире или хлороформе. Растворимость NH4NO3 зависит от присутствия других веществ, например кислот, оснований, солей или органических соединений. Некоторые из этих веществ могут повлиять на стабильность NH4NO3 и вызвать его разложение или взрыв.
| Появление | Белое кристаллическое твердое вещество |
| Удельная плотность | 1725 |
| Цвет | Белый или серый |
| Запах | Без запаха |
| Молярная масса | 80,043 г/моль |
| Плотность | 1,725 г/мл или 1725 кг/м3 |
| Точка плавления | 169,6°С или 442,8К |
| Точка кипения | Примерно. 210°C или 483 К (разлагается) |
| Мигающая точка | Не воспламеняется |
| Растворимость в воде | Эндотермический, 118г/100мл (0°С), 150г/100мл (20°С), 297г/100мл (40°С), 410г/100мл (60°С), 576г/100мл (80°С), 1024г/100мл (100°С) |
| Растворимость | Растворим в воде, метаноле, этаноле, ацетоне; нерастворим в диэтиловом эфире, хлороформе |
| Давление газа | Незначительно при комнатной температуре |
| Плотность пара | Не применимо (сплошное) |
| пКа | 9,25 (для NH4+) |
| рН | 5,0-6,0 (10% водный раствор) |
Безопасность и вред аммиачной селитры
Безопасность и опасность NH4NO3 важно знать всем, кто работает с этим химическим соединением или хранит его. NH4NO3 — окислитель, который может усилить пожар и вызвать взрывы при смешивании с горючими материалами или при воздействии тепла, удара или загрязнения. NH4NO3 также может выделять при разложении токсичные газы, такие как оксиды азота и аммиак. Поэтому при работе с NH4NO3 людям следует соблюдать следующие меры предосторожности:
- Храните его в прохладном, сухом, хорошо проветриваемом месте вдали от источников огня, органических веществ, кислот, металлов и других несовместимых материалов.
- При работе надевайте защитную одежду, перчатки, средства защиты глаз и лица.
- Избегайте образования пыли и используйте достаточную вентиляцию при транспортировке.
- После работы тщательно вымойте руки и лицо.
- Не глотайте и не вдыхайте его и в случае воздействия обратитесь к врачу.
- Сообщите местным службам экстренной помощи о наличии NH4NO3 на объекте и подготовьте план действий в чрезвычайной ситуации.
| Символы опасности | O (окислитель), Xi (раздражитель) |
| Описание безопасности | S17 (беречь от горючих материалов), S26 (при попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу), S36/37/39 (носить подходящую защитную одежду, перчатки и средства защиты глаз/лица), S42 (во время фумигации/опрыскивания надевайте соответствующее респираторное оборудование) |
| Идентификационные номера ООН | S17 (беречь от горючих материалов), S26 (при попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу), S36/37/39 (носить подходящую защитную одежду, перчатки и средства защиты глаз/лица), S42 (во время фумигации/опрыскивания надевайте соответствующее респираторное оборудование) |
| код ТН ВЭД | 3102.30 (нитрат аммония, в водном растворе или нет) |
| Класс опасности | 5.1 (окислитель) |
| Группа упаковки | III (низкая опасность) |
| Токсичность | LD50 (перорально, крыса) = 2085–5300 мг/кг. |
Методы синтеза нитрата аммония
Для получения этого химического соединения, широко используемого в качестве удобрения и взрывчатого вещества, химики используют различные методы синтеза NH4NO3. Существуют разные методы синтеза NH4NO3, но наиболее распространенными являются:
- Процесс Габера-Боша и Оствальда. Этот метод включает реакцию газов азота и водорода с образованием аммиака, а затем окисление аммиака воздухом с образованием азотной кислоты . Для образования NH4NO3 они нейтрализуют аммиак и азотную кислоту. Этот метод требует высокой температуры, давления и энергии и выделяет много углекислого газа.
- Реакция метатезиса. Этот метод включает взаимодействие растворимой соли аммония с растворимой нитратной солью с образованием NH4NO3 и другой соли. Например, сульфат аммония и нитрат бария могут вступать в реакцию с образованием NH4NO3 и сульфата бария. Этот метод прост и не требует высокой температуры или давления, но дает побочный продукт, который, возможно, придется отделить или утилизировать.
- Плазменный процесс. Этот метод заключается в использовании плазмы при низкой температуре и низком давлении для фиксации азота из воздуха в почве, образуя таким образом NH4NO3 непосредственно в почве. Этот метод не требует газообразного водорода или катализаторов и не выделяет углекислый газ. Он также может обогатить почву азотом и улучшить рост растений.
Применение нитрата аммония
Вот некоторые варианты использования NH4NO3:
- Удобрение: NH4NO3 является распространенным источником азота для растений, поскольку оно содержит около 33,5% азота, который доступен для поглощения растениями. Производители покрывают белые или серые гранулы карбоната аммония глиной, чтобы они не слеживались и не впитывали влагу. Его можно применять в твердой форме или в растворе, поскольку вода легко растворяет его.
- Взрывчатое вещество: NH4NO3 является окислителем, который может усиливать детонацию других взрывчатых веществ, таких как нитроглицерин, тротил, гексоген или алюминиевый порошок. Широко используемое промышленное взрывчатое вещество, на долю которого приходится 80% взрывчатых веществ, используемых в Северной Америке, в качестве основного ингредиента содержит ANFO (NH4NO3 и мазут). Для его детонации при использовании в самодельных взрывных устройствах требуется мощный инициатор, но его также можно использовать в промышленных целях.
- Пиротехника. В фейерверках NH4NO3 можно использовать для создания различных эффектов, таких как дым, искры, звезды и молнии. Его также можно использовать для холодных компрессов, которые при смешивании с водой вызывают эндотермическую реакцию.
- Другое применение: используется в качестве предшественника закиси азота (веселящего газа), анестетика и пропеллента. В качестве абсорбентов можно использовать оксиды азота, в качестве питательных веществ — дрожжи и антибиотики, а в качестве компонентов — смеси для заморозки.
Вопросы:
Вопрос: Откуда берутся аммиачно-нитратные удобрения?
Ответ: Удобрение NH4NO3 представляет собой синтетический продукт, образующийся в результате реакции аммиака и азотной кислоты. Аммиак получают из природного газа или других источников, а азотную кислоту получают путем окисления аммиака воздухом. Удобрение NH4NO3 также можно производить с использованием плазменного процесса, который фиксирует азот из воздуха в почву.
Вопрос: Что такое нитрат аммония?
Ответ: NH4NO3 — химическое соединение формулы NH4NO3. Это белая кристаллическая соль, состоящая из ионов аммония и нитрата. Он хорошо растворим в воде и гигроскопичен в твердой форме, хотя не образует гидратов.
Вопрос: Для чего используется нитрат аммония?
Ответ: NH4NO3 в основном используется для двух целей: в качестве удобрения и в качестве взрывчатого вещества. В качестве удобрения он обеспечивает растения азотом, необходимым для их роста и обмена веществ. В качестве взрывчатого вещества он действует как окислитель, который способствует детонации других взрывчатых веществ, таких как ANFO (NH4NO3 и мазут) 1 . Его также можно использовать для других целей, например, для приготовления закиси азота (веселящего газа), холодных компрессов, фейерверков и питательных веществ для дрожжей.
Вопрос: Какова молекулярная формула нитрата аммония?
A: Молекулярная формула нитрата аммония — NH4NO3. Он имеет молярную массу 80 043 г/моль и содержит 35% азота по массе.
Вопрос: Из чего состоит удобрение из аммиачной селитры?
О: Удобрение NH4NO3 состоит из NH4NO3 и иногда других добавок, таких как глина, средства против слеживания или стабилизаторы. Коммерческий сорт содержит около 33,5% азота, все в формах, доступных для потребления растениями.
Вопрос: Нитрат аммония – это кислота или основание?
Ответ: NH4NO3 не является ни кислотой и не основанием, а солью. Он может диссоциировать в воде на ионы аммония и нитрата, которые могут действовать как слабые кислоты или основания в зависимости от pH раствора. Ион аммония имеет pKa 9,25, что означает, что он может отдавать протон и действовать как кислота в основных растворах. Нитрат-ион не имеет pKa, то есть он не может отдавать или принимать протоны, но может действовать как основание, образуя азотную кислоту с ионами гидроксония в кислых растворах.
Вопрос: Взрыв аммиачной селитры?
Ответ: Взрыв NH4NO3 — это бурная химическая реакция, которая происходит, когда NH4NO3 быстро разлагается и выделяет большое количество газов, таких как азот, кислород и водяной пар. Разложение может быть вызвано нагреванием, ударом, трением, загрязнением или ограничением свободы. Взрыв NH4NO3 может нанести серьезный ущерб зданиям, людям и окружающей среде. Некоторыми примерами взрывов NH4NO3 являются катастрофа в Техас-Сити в 1947 году, взрыв в Оппау в 1921 году, взрыв в Тяньцзине в 2015 году и взрыв в Бейруте в 2020 году.
Вопрос: Как купить аммиачную селитру?
О: Для приобретения NH4NO3 может потребоваться лицензия или разрешение в зависимости от страны или региона, в котором вы живете. Действительно, NH4NO3 можно использовать для изготовления взрывчатых веществ или самодельных взрывных устройств, которые могут представлять угрозу общественной безопасности. При покупке NH4NO3 от вас также может потребоваться указать свою личность, адрес, контактные данные и предполагаемое использование продукта. NH4NO3 можно приобрести у проверенных поставщиков или дистрибьюторов, которые соблюдают местные правила и стандарты. Вам также следует соблюдать правила правильного хранения и обращения, чтобы избежать несчастных случаев или неправильного использования NH4NO3.
