Метабисульфит натрия (Na2S2O5) — химическое соединение, используемое в качестве консерванта и антиоксиданта в пищевых продуктах и напитках. Его также можно использовать в качестве дезинфицирующего и отбеливающего средства в различных отраслях промышленности.
| Название ИЮПАК | Пиросульфит натрия |
| Молекулярная формула | Na2S2O5 |
| Количество CAS | 7681-57-4 |
| Синонимы | Дисульфит натрия, пиросернистая кислота, динатриевая соль, пиросульфит натрия, дисульфит натрия |
| ИнЧИ | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /п-2 |
Свойства метабисульфита натрия
Формула метабисульфита натрия
Химическая формула метабисульфита натрия: Na2S2O5. Он состоит из двух ионов натрия (Na+) и одного дисульфит-иона (S2O5-2). Соединение представляет собой белый или желтоватый кристаллический порошок, растворимый в воде и издающий резкий запах.
Метабисульфит натрия Молярная масса
Молярная масса Na2S2O5 составляет 190,107 г/моль. Это значение рассчитывается путем сложения атомных масс элементов соединения, которые составляют 22,99 г/моль для натрия, 32,06 г/моль для серы и 15,99 г/моль для кислорода. Молярная масса — важное свойство, которое помогает определить, какое количество вещества необходимо для химической реакции.
Температура кипения метабисульфита натрия
Na2S2O5 имеет высокую температуру плавления — 150°C, но он разлагается, не успев закипеть. Соединение разлагается на диоксид серы (SO2) и сульфит натрия (Na2SO3) при температуре примерно 150°C. Поэтому температура кипения Na2S2O5 неприменима.
Метабисульфит натрия. Температура плавления.
Температура плавления Na2S2O5 составляет 150°С. При этой температуре соединение претерпевает фазовый переход из твердого состояния в жидкость. Температура плавления — важное физическое свойство, которое помогает идентифицировать и охарактеризовать вещество.
Плотность метабисульфита натрия г/мл
Плотность Na2S2O5 составляет 1,48 г/мл. Это относительно плотное соединение, которое тонет в воде. Плотность вещества — это масса единицы объема и важное физическое свойство, помогающее определить, сколько вещества находится в данном объеме.
Метабисульфит натрия Молекулярный вес
Молекулярная масса Na2S2O5 составляет 190,107 г/моль. Это сумма атомных весов всех атомов соединения. Молекулярный вес – важное свойство, помогающее рассчитать количество вещества, необходимое для химической реакции.
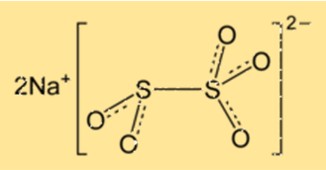
Структура метабисульфита натрия
Na2S2O5 имеет кристаллическую структуру и принадлежит к ромбической кристаллической системе. Кристаллическая решетка состоит из ионов натрия и дисульфит-ионов, расположенных повторяющимся узором. Соединение имеет тетраэдрическую молекулярную геометрию с атомами серы в центре тетраэдра.
Растворимость метабисульфита натрия
Na2S2O5 хорошо растворим в воде, его растворимость составляет 54 г/100 мл при 25°C. Он также растворим в глицерине и слабо растворим в этаноле. Растворимость вещества — важное свойство, определяющее его способность растворяться в данном растворителе.
| Появление | Белый или желтоватый кристаллический порошок |
| Удельный вес | 1,48 |
| Цвет | От белого до желтоватого |
| Запах | Акко |
| Молярная масса | 190,107 г/моль |
| Плотность | 1,48 г/мл |
| Точка плавления | 150°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | 54 г/100 мл при 25°C |
| Растворимость | Растворим в глицерине и слабо растворим в этаноле. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | 7.2 |
| рН | 4,5 (5% раствор) |
Безопасность и опасность метабисульфита натрия
Na2S2O5 может быть опасен при неправильном обращении. Это сильный восстановитель, который при воздействии может вызвать раздражение кожи, глаз и дыхательной системы. Проглатывание соединения может вызвать серьезные желудочно-кишечные расстройства. Na2S2O5 следует хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых материалов. Его нельзя смешивать с сильными кислотами, сильными окислителями или восстановителями. При работе с составом следует использовать защитное оборудование, такое как перчатки, очки и респираторы. Аварийные средства, такие как станции для промывания глаз и огнетушители, должны быть легко доступны в случае аварии.
| Символы опасности | Си (раздражает) |
| Описание безопасности | Избегайте контакта с кожей и глазами. Надевайте защитную одежду и перчатки. Не глотать. Используйте при достаточной вентиляции. |
| Идентификационные номера ООН | ООН 2676 |
| код ТН ВЭД | 2832.10.00 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | III |
| Токсичность | LD50 (перорально, крыса): 1000 мг/кг; LC50 (ингаляция, крыса): 11 мг/л (4 часа) |
Методы синтеза метабисульфита натрия
Na2S2O5 можно синтезировать различными методами, в том числе взаимодействием бисульфита натрия с диоксидом серы в присутствии такого окислителя, как перекись водорода . В процессе нагревается аддукт бисульфита натрия и диоксида серы с образованием Na2S2O5.
Другой метод предполагает реакцию гидроксида натрия с сернистым газом с последующим добавлением серной кислоты с образованием сульфата натрия и Na2S2O5.
Другой метод синтеза включает взаимодействие карбоната натрия с диоксидом серы и последующее нагревание полученного сульфита натрия в присутствии воздуха. В результате этого процесса образуется сульфат натрия и Na2S2O5.
В присутствии окислителя, такого как перекись водорода или азотная кислота, Na2S2O5 можно получить взаимодействием серы с сульфитом натрия.
В промышленности наиболее распространенным методом синтеза Na2S2O5 является реакция бисульфита натрия с диоксидом серы в присутствии такого катализатора, как диоксид марганца. При нагревании аддукта бисульфита натрия/диоксида серы образуется Na2S2O5.
Использование метабисульфита натрия
Na2S2O5 находит различное применение в нескольких отраслях промышленности благодаря своим сильным восстановительным свойствам и способности действовать как консервант и антиоксидант. Некоторые из распространенных применений Na2S2O5 включают:
- Пищевая промышленность и производство напитков: широко используется в качестве консерванта и антиоксиданта в продуктах питания и напитках, таких как вино, пиво, фруктовые соки и сухофрукты. Это помогает предотвратить порчу и окисление этих продуктов, тем самым продлевая срок их хранения.
- Фармацевтическая промышленность: используется в качестве антиоксиданта в различных фармацевтических продуктах, таких как кремы, мази и таблетки. Это помогает предотвратить деградацию этих продуктов из-за воздействия воздуха и света.
- Водоочистка: используется для дехлорирования воды на водоочистных станциях. Это помогает устранить избыток хлора и хлораминов, которые могут быть вредны для водной флоры и фауны.
- Фотография: используется в качестве проявителя и фиксатора фотографий в фотоиндустрии. Он помогает восстановить ионы серебра до металлического серебра, формируя таким образом фотографическое изображение.
- Текстильная промышленность: Используется в качестве восстановителя в текстильной промышленности при крашении и печати. Это помогает удалить излишний кислород из раствора красителя, улучшая интенсивность и однородность цвета.
Вопросы:
Вопрос: Где я могу купить метабисульфит натрия на месте?
Ответ: Na2S2O5 обычно можно найти в химических магазинах или интернет-магазинах. Его также можно приобрести в некоторых специализированных продовольственных магазинах, поскольку он обычно используется в качестве консерванта в пищевой промышленности.
Вопрос: Где купить метабисульфит натрия?
О: Na2S2O5 можно приобрести в химических магазинах или в специализированных интернет-магазинах химической продукции. Его также можно приобрести в некоторых специализированных продовольственных магазинах.
Вопрос: Безопасен ли метабисульфит натрия?
Ответ: Na2S2O5 может быть опасен при неправильном обращении. При работе с этим соединением важно носить соответствующее защитное оборудование и соблюдать меры предосторожности. Он может вызвать раздражение кожи и глаз, а также выделять токсичный диоксид серы при смешивании с кислотой. Однако при использовании в соответствующих концентрациях и осторожном обращении Na2S2O5 обычно считается безопасным для использования по назначению.
Вопрос: Можете ли вы превратить бисульфат натрия в метабисульфит натрия?
Ответ: Да, бисульфат натрия (NaHSO4) можно превратить в Na2S2O5, нагрев его до высокой температуры в присутствии окислителя, например перекиси водорода. В результате реакции выделяется вода и образуется Na2S2O5.
Вопрос: В чем разница между бисульфитом натрия и метабисульфитом натрия?
Ответ: Основное различие между NaHSO3 и Na2S2O5 заключается в их химической структуре. Бисульфит натрия имеет одну сульфитную группу (-SO3) и один ион водорода (H+), а Na2S2O5 имеет две связанные вместе сульфитные группы (-SO3). Na2S2O5 также более стабилен и имеет более длительный срок хранения, чем бисульфит натрия.
Вопрос: Какова степень окисления S в Na2S2O5?
A: Степень окисления серы (S) в Na2S2O5 равна +5.
Вопрос: Как найти концентрацию IO3- по KIO3 и Na2S2O5?
Ответ: Концентрацию IO3- можно определить титрованием тиосульфатом натрия известной концентрации (Na2S2O3), используя в качестве индикатора крахмал. В результате реакции KIO3 с Na2S2O5 образуется йод (I2), который реагирует с Na2S2O3 с образованием NaI и Na2S4O6. Измерив объем Na2S2O3, необходимый для реакции с йодом, можно рассчитать концентрацию IO3-.
Вопрос: Какие ионы содержит Na2S2O5?
Ответ: Na2S2O5 состоит из двух ионов натрия (Na+) и одного дисульфитного иона (-S2O5).
