Кротоновый альдегид — ненасыщенный альдегид с химической формулой C4H6O. Его используют в производстве пластмасс, смол и других химических соединений.
| Название ИЮПАК | Но-2-энал |
| Молекулярная формула | C4H6O |
| Количество CAS | 123-73-9 |
| Синонимы | Пропеналь, кротоновый альдегид, 2-бутеналь, (2Е)-бут-2-еналь, кротилальдегид |
| ИнЧИ | ИнЧИ=1S/C4H6O/c1-2-3-4-5/h2-4H,1H3 |
Свойства кротональдегида
Формула кротональдегида
Формула кротонового альдегида: C4H6O. Он представляет химический состав кротонового альдегида, указывая на то, что он состоит из четырех атомов углерода, шести атомов водорода и одного атома кислорода. Формула дает краткое представление об атомах и их расположении внутри молекулы кротонового альдегида.
кротональдегид Молярная масса
Молярная масса кротонового альдегида равна сумме атомных масс составляющих его элементов. Кротоновый альдегид имеет молярную массу примерно 70,09 грамма на моль (г/моль). Это значение получается сложением атомных масс четырех атомов углерода (по 12,01 г/моль каждый), шести атомов водорода (по 1,01 г/моль каждый) и одного атома кислорода (по 16,00 г/моль каждый). мол).
Температура кипения кротональдегида
Кротоновый альдегид имеет температуру кипения примерно 104,2 градуса Цельсия (°C). Это температура, при которой кротоновый альдегид переходит из жидкого состояния в газообразное при стандартном атмосферном давлении. Температура кипения дает важную информацию о летучести и физических свойствах кротонового альдегида.
Кротональдегид Температура плавления
Температура плавления кротонового альдегида составляет примерно -76,5°С. Это температура, при которой кротоновый альдегид переходит из твердого состояния в жидкое. Температура плавления является важной характеристикой для понимания поведения кротонового альдегида в различных процессах, таких как производство, хранение и обращение.
Плотность кротональдегида г/мл
Плотность кротонового альдегида обычно составляет около 0,846 грамма на миллилитр (г/мл). Плотность является мерой массы единицы объема и указывает на компактность вещества. Плотность кротонового альдегида дает представление о его физических свойствах и поведении при взаимодействии с другими веществами.
Кротональдегид Молекулярный вес
Молекулярная масса кротонового альдегида составляет примерно 70,09 г/моль. Это сумма атомных весов всех атомов молекулы кротонового альдегида. Молекулярная масса является ключевым фактором в различных расчетах и преобразованиях с участием кротонового альдегида, включая определение количества вещества в молях и установление стехиометрических соотношений в химических реакциях.
Структура кротональдегида
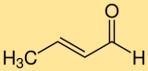
Кротоновый альдегид имеет химическую структуру, состоящую из четырехуглеродной цепи с двойной связью между вторым и третьим атомами углерода. Концевой углерод несет альдегидную функцию (―CHO). Такое структурное расположение придает кротоновому альдегиду его уникальные свойства и реакционную способность.
Растворимость кротональдегида
Кротоновый альдегид обладает ограниченной растворимостью в воде: всего около 1,3 грамма кротонового альдегида растворяется в 100 миллилитрах (мл) воды при комнатной температуре. Однако он более растворим в органических растворителях, таких как этанол и ацетон. Растворимость кротонового альдегида влияет на его поведение и взаимодействие в различных химических процессах и применениях.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,846 г/мл |
| Цвет | Бесцветный |
| Запах | Пряный, фруктовый |
| Молярная масса | 70,09 г/моль |
| Плотность | 0,846 г/мл |
| Точка плавления | -76,5°С |
| Точка кипения | 104,2°С |
| Мигающая точка | -2,8°С |
| Растворимость в воде | 1,3 г/100 мл при 25°C |
| Растворимость | Растворим в органических растворителях, таких как этанол и ацетон. |
| Давление газа | 45,3 мм рт.ст. при 25°C |
| Плотность пара | 2,42 (воздух = 1) |
| пКа | 13,0 |
| рН | Около 6,4-7,4 |
Безопасность и опасность кротональдегида
Кротоновый альдегид представляет потенциальную угрозу безопасности, и с ним следует обращаться с осторожностью. Он считается легковоспламеняющимся и может воспламениться при воздействии огня или источника тепла. Прямой контакт с кротоновым альдегидом может вызвать раздражение кожи и глаз, а вдыхание его паров может вызвать раздражение дыхательной системы. При работе с кротоновым альдегидом следует использовать соответствующую вентиляцию и средства индивидуальной защиты, такие как перчатки и очки. Кроме того, важно хранить кротоновый альдегид и обращаться с ним в хорошо проветриваемом помещении, вдали от несовместимых веществ. В случае проглатывания или длительного воздействия следует немедленно обратиться за медицинской помощью. Крайне важно следовать протоколам и рекомендациям по безопасности, чтобы минимизировать риски, связанные с кротоновым альдегидом.
| Символы опасности | Легковоспламеняющийся (F), Раздражающий (Xi) |
| Описание безопасности | Хранить вдали от источников тепла и возгорания. Используйте в хорошо проветриваемом помещении. Наденьте перчатки и защитные очки. Избегайте контакта с кожей и глазами. |
| Идентификационные номера ООН | ООН 1148 |
| код ТН ВЭД | 2912.19.0000 |
| Класс опасности | Класс 3 – Легковоспламеняющиеся жидкости |
| Группа упаковки | ГЭ II |
| Токсичность | Умеренно токсичен при проглатывании |
Методы синтеза кротональдегида
Различные методы позволяют синтезировать кротоновый альдегид. Распространенным методом является реакция альдольной конденсации. В этом процессе ацетальдегид подвергается самоконденсации в присутствии основного катализатора, такого как гидроксид натрия или гидроксид калия. Основание облегчает удаление альфа-водорода из молекулы ацетальдегида , образуя енолят-ион. Енолят-ион затем реагирует с другой молекулой ацетальдегида , в результате чего образуется кротоновый альдегид.
Другой метод включает дегидрирование кротоновой кислоты. Подходящий катализатор, такой как медь, цинк или никель, облегчает дегидрирование кротоновой кислоты, которую можно получить из акриловой кислоты . В процессе дегидрирования из кротоновой кислоты удаляются два атома водорода, в результате чего образуется кротоновый альдегид.
Кротоновый альдегид можно синтезировать путем окисления н-бутанола . Для проведения реакции окисления обычно используют окислитель, такой как триоксид хрома или дихромат калия, в присутствии серной кислоты. При окислении н-бутанола в качестве одного из основных продуктов образуется кротоновый альдегид.
Эти методы синтеза предлагают различные пути получения кротонового альдегида, что позволяет производить его в промышленных масштабах. Выбор метода синтеза зависит от таких факторов, как доступность и стоимость сырья, желаемые условия реакции и общая эффективность процесса.
Использование кротональдегида
Кротоновый альдегид находит несколько применений в различных отраслях промышленности и применениях. Вот некоторые известные варианты использования:
- Химическое промежуточное соединение: кротоновый альдегид играет решающую роль в синтезе различных химических веществ, включая фармацевтические препараты, парфюмерию и сельскохозяйственную продукцию.
- Смолы и пластмассы: способствует структурной целостности и эксплуатационным свойствам смол и пластмасс, улучшая их общее качество.
- Резиновая промышленность: Резиновая промышленность использует кротоновый альдегид в качестве сомономера при производстве синтетических каучуков, таких как нитрильный каучук, для улучшения эластичности и устойчивости.
- Клеи: кротоновый альдегид является важным компонентом в составе клеев, которые обеспечивают прочные и долговечные соединения в столярных, упаковочных и строительных целях.
- Вкусовая и парфюмерная промышленность: кротоновый альдегид придает уникальный вкус и аромат пищевым продуктам, напиткам и парфюмерии, повышая их сенсорную привлекательность.
- Применение в сельском хозяйстве: он служит промежуточным продуктом в синтезе соединений, используемых для борьбы с вредителями и защиты сельскохозяйственных культур, тем самым способствуя сельскохозяйственному применению в качестве пестицида.
- Реакции полимеризации: Кротоновый альдегид активно участвует в реакциях полимеризации, образуя полимерные соединения с различными свойствами, которые находят применение в покрытиях, красках и клеях.
- Химические исследования и анализ: он служит эталонным соединением в аналитической химии, позволяя идентифицировать и количественно определять кротоновый альдегид в различных образцах.
- Обработка поверхности: кротоновый альдегид модифицирует поверхность материала, придавая ему желаемые характеристики, такие как водоотталкивающие свойства и устойчивость к коррозии.
- Фармацевтические препараты: он действует как предшественник при синтезе фармацевтических соединений, играя важную роль в разработке лекарств для различного терапевтического применения.
Универсальность кротонового альдегида делает его неоценимым в различных отраслях промышленности, поскольку позволяет создавать разнообразный ассортимент продуктов, которые играют решающую роль в нашей повседневной жизни.
Вопросы:
Вопрос: Сколько сигма-связей имеет кротональдегид?
Ответ: Кротоновый альдегид имеет в своей структуре 9 сигма-связей.
Вопрос: Какова формула массы кротональдегида C4H6O?
A: Формульная масса кротонового альдегида составляет примерно 70,09 грамма на моль (г/моль).
Вопрос: Как отличить валельдегид от кротональдегида?
A: Валеральдегид имеет линейную структуру с пятью атомами углерода, тогда как кротоновый альдегид имеет четырехуглеродную цепь с двойной связью между вторым и третьим атомом углерода.
Вопрос: Что такое кротональдегид?
Ответ: Кротоновый альдегид используется в производстве пластмасс, смол, фармацевтических препаратов, парфюмерии, резины, клеев, а также в качестве вкусоароматического компонента.
Вопрос: Структура Льюиса кротонового альдегида?
A: Структура Льюиса кротонового альдегида состоит из четырехуглеродной цепи с двойной связью между вторым и третьим атомами углерода и концевого атома углерода с альдегидной функциональной группой (―CHO).
Вопрос: ЯМР кротональдегида?
A: Спектр ЯМР кротонового альдегида показывает характерные пики для различных углеродных и водородных сред в его структуре, что облегчает его идентификацию и анализ.
Вопрос: Кротональдегидное гидрирование Au и Pt?
Ответ: Золотые (Au) и платиновые (Pt) катализаторы можно использовать для гидрирования кротонового альдегида, что приводит к превращению двойной связи в одинарную и образованию кротонового спирта.
