Карбонат натрия или карбонат натрия — неорганическое соединение с химической формулой Na2CO3. Это щелочная соль белого цвета, растворимая в воде. Он используется во многих промышленных и коммерческих процессах, например, при производстве стекла, бумаги, мыла, моющих и чистящих средств.
| Название ИЮПАК | Карбонат натрия |
| Молекулярная формула | Na2CO3 |
| Количество CAS | 497-19-8 |
| Синонимы | Безводный Na2CO3, декагидрат Na2CO3, стиральная сода, карбонат натрия. |
| ИнЧИ | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
Свойства карбоната натрия
Карбонат натрия Молярная масса
Молярная масса карбоната натрия составляет 106,0 г/моль. Это сумма атомных масс всех атомов в молекуле карбоната натрия. Молярная масса — важное физическое свойство, используемое во многих расчетах в химии и других науках.
Температура кипения карбоната натрия
Карбонат натрия имеет температуру кипения 1600°С. Это температура, при которой давление паров жидкости равняется давлению окружающей атмосферы и жидкость кипит. Температура кипения — полезное свойство для идентификации и разделения различных соединений.
Температура плавления карбоната натрия
Na2CO3 имеет температуру плавления 851°C. Это температура, при которой твердая форма соединения превращается в жидкость. Температура плавления — важное свойство, используемое при идентификации и очистке различных веществ.
Плотность карбоната натрия г/мл
Na2CO3 имеет плотность 2,54 г/мл. Плотность определяется как масса единицы объема вещества и является полезным свойством для определения концентрации раствора.
Молекулярный вес карбоната натрия
Молекулярная масса карбоната натрия составляет 106 г/моль. Это сумма атомных весов всех атомов молекулы. Молекулярный вес — важное свойство, используемое во многих расчетах в химии и других науках.
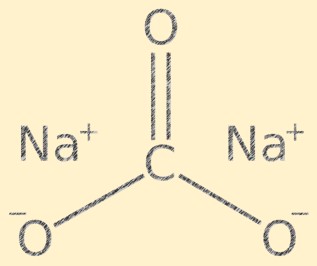
Структура карбоната натрия
Na2CO3 имеет кристаллическую структуру и состоит из катионов натрия (Na+) и карбонат-анионов (CO3-). Карбонат-ион имеет плоскую тригональную форму с атомом углерода в центре и присоединенными к нему атомами кислорода под углом 120 градусов. Ионы натрия и ионы карбоната удерживаются вместе ионными связями, придавая соединению характерную кристаллическую структуру.
| Появление | Белый кристаллический порошок или мелкие белые кристаллы. |
| Удельный вес | 2,54 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 106,0 г/моль |
| Плотность | 2,54 г/мл |
| Точка плавления | 851°С |
| Точка кипения | 1600°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворим в воде |
| Растворимость | Растворим в глицерине, слабо растворим в этаноле. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | 10.3 |
| рН | 11,6 (1М раствор) |
Безопасность и опасность карбоната натрия
Карбонат натрия является основным соединением и может вызывать раздражение кожи и глаз. Вдыхание его пыли может вызвать раздражение дыхательных путей. Он также вреден при проглатывании и может вызвать расстройство пищеварения. Обращение следует проводить в перчатках и защитных очках, вещество следует хранить в сухом прохладном месте вдали от источников возгорания. Избегайте проглатывания или вдыхания порошка и тщательно мойте его после работы.
| Символы опасности | XI, Н |
| Описание безопасности | Раздражающий |
| Идентификационные номера ООН | 1824 год |
| код ТН ВЭД | 2836.90.90 |
| Класс опасности | 8 |
| Группа упаковки | III |
| Токсичность | Пероральная LD50 (крыса) = 915 мг/кг. LC50 при вдыхании (крыса) = >10 мг/л/4 часа. При вдыхании может вызвать раздражение кожи и глаз, раздражение дыхательных путей. Может быть вреден при проглатывании. |
Методы синтеза карбоната натрия
Карбонат натрия можно синтезировать двумя основными методами: процессом Сольвея и методом осаждения. Процесс Сольвея, также известный как аммиачно-содовый процесс, включает реакцию хлорида натрия, аммиака и углекислого газа с образованием карбоната натрия, хлорида аммония и воды. Метод осаждения включает реакцию гидроксида натрия и диоксида углерода с образованием карбоната натрия и воды. Оба метода позволяют получить продукт высокой чистоты, который можно использовать для различных применений, таких как очистка воды, производство мыла и моющих средств, а также производство стекла. Процесс Сольвея является наиболее часто используемым методом из-за его более низких производственных затрат и более высокого выхода продукции.
Использование карбоната натрия
Промышленность использует карбонат натрия или стиральную соду для различных целей. В промышленности по производству моющих средств он используется в качестве смягчителя воды и регулятора pH, стекольная промышленность использует его для создания плоского стекла, упаковочного стекла и специального стекла, а бумажная промышленность использует его для нейтрализации кислых потоков отходов и регулирования pH. В химической промышленности карбонат натрия является ключевым ингредиентом при производстве силикатов и бикарбонатов натрия. Он также служит пищевой добавкой и чистящим средством в котлах и процессах очистки воды в пищевой промышленности. Кроме того, карбонат натрия играет роль в производстве красителей, эмалей, керамики и действует как огнетушитель в огнетушителях.
