Дихромат калия — ярко-оранжевое химическое соединение, используемое в различных областях. Это сильный окислитель, который может быть токсичным при проглатывании или вдыхании.
| Название ИЮПАК | Дихромат калия |
| Молекулярная формула | К2Cr2O7 |
| Количество CAS | 7778-50-9 |
| Синонимы | Бихромат калия, Хромат калия (VI), Бихромат калия |
| ИнЧИ | InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;/h;;2*;7*1- |
Свойства дихромата калия
Формула дихромата калия
Формула дихромата калия: K2Cr2O7. Он состоит из двух атомов калия (K), двух атомов хрома (Cr) и семи атомов кислорода (O). Каждый атом калия имеет заряд +1, а каждый атом хрома — заряд +6. Наличие в формуле двух атомов хрома указывает на димерное строение соединения.
дихромат калия Молярная масса
Молярную массу дихромата калия рассчитывают путем сложения атомных масс составляющих его элементов. Калий имеет молярную массу 39,10 грамм на моль (г/моль), хром имеет молярную массу 52,00 г/моль, а кислород имеет молярную массу 16,00 г/моль. Таким образом, молярная масса дихромата калия составляет 294,18 г/моль.
Температура кипения дихромата калия
Бихромат калия не имеет определенной температуры кипения, так как он разлагается, не достигнув точки кипения. Однако при нагревании он подвергается термическому разложению с выделением токсичных паров оксида хрома и кислорода.
Дихромат калия Температура плавления
Температура плавления дихромата калия составляет примерно 398 градусов Цельсия (°C) или 748 градусов по Фаренгейту (°F). При этой температуре твердые кристаллы дихромата калия переходят в жидкое состояние.
Плотность дихромата калия г/мл
Плотность дихромата калия составляет примерно 2,68 грамма на миллилитр (г/мл). Это указывает на то, что данный объем дихромата калия относительно тяжелее, чем равный объем воды.
Молекулярный вес дихромата калия
Молекулярная масса дихромата калия равна его молярной массе, которая составляет 294,18 грамма на моль (г/моль). Он представляет собой совокупную массу всех атомов, присутствующих в молекуле соединения.
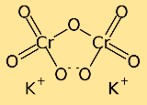
Структура дихромата калия
Дихромат калия имеет димерную структуру, то есть он состоит из двух атомов хрома, связанных между собой атомами кислорода. Атомы калия также связаны с атомами кислорода, создавая сложную сеть атомов в соединении.
Растворимость дихромата калия
Дихромат калия хорошо растворим в воде. Он легко растворяется в воде с образованием оранжевого раствора. Растворимость дихромата калия увеличивается с температурой. Однако его растворимость в органических растворителях ограничена.
| Появление | Ярко-оранжевые кристаллы |
| Удельный вес | 2,68 г/мл |
| Цвет | Апельсин |
| Запах | Без запаха |
| Молярная масса | 294,18 г/моль |
| Плотность | 2,68 г/мл |
| Точка плавления | 398°С (748°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде, ограничено в органических растворителях. |
| Давление газа | Незначительный |
| Плотность пара | Нет в наличии |
| пКа | Непригодный |
| рН | Кислый (около pH 4) |
Безопасность и опасность дихромата калия
Дихромат калия представляет значительную угрозу безопасности. Он очень токсичен при проглатывании, вдыхании или попадании на кожу. Соединение является сильным окислителем, который может бурно реагировать с горючими материалами, увеличивая риск возгорания. Воздействие дихромата калия может вызвать сильное раздражение кожи, ожоги и аллергические реакции. Вдыхание его паров или пыли может вызвать проблемы с дыханием и повреждение легких. Длительное воздействие связано с неблагоприятными последствиями для здоровья, включая рак легких, вызванный хроматом. Крайне важно обращаться с дихроматом калия с особой осторожностью, носить соответствующие защитные средства и обеспечивать достаточную вентиляцию, чтобы свести к минимуму риски для здоровья и безопасности.
| Символы опасности | Коррозийный, Опасен для здоровья, Острая токсичность |
| Описание безопасности | – Очень токсично – Коррозионно – Вызывает ожоги |
| Идентификационные номера ООН | ООН 3086 (класс 6.1) |
| код ТН ВЭД | 2841.10.10 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | III |
| Токсичность | Острая пероральная токсичность: Очень токсично<br>Хроническая токсичность: Канцерогенный потенциал. |
Примечание. Символы опасности, используемые в таблице, являются общепризнанными международными символами. Для получения полной информации об обращении и хранении дихромата калия важно обращаться к конкретным правилам и инструкциям по безопасности.
Методы синтеза дихромата калия
Существует несколько методов синтеза дихромата калия. Обычно используемый метод включает реакцию между хроматом калия (K2CrO4) и хромовой кислотой (H2CrO4) . Реакция протекает в кислой среде, обычно с серной кислотой (H2SO4) в качестве катализатора. Реакция может подвести итог.
2K2CrO4 + 2H2CrO4 + 2H2SO4 → K2Cr2O7 + Cr2(SO4)3 + 4H2O
Другой метод включает окисление хромата калия с использованием сильного окислителя, например концентрированной серной кислоты (H2SO4) , и восстановителя, например этанола (C2H5OH). Реакция может подвести итог.
2K2CrO4 + H2SO4 + 3C2H5OH → K2Cr2O7 + Cr2(SO4)3 + 7H2O + 3CO2
Гидроксид калия (KOH) реагирует с триоксидом хрома (CrO3) в водной среде с образованием дихромата калия. В водной среде протекает реакция. Реакция может подвести итог.
2KOH + CrO3 → K2Cr2O7 + H2O
Эти методы синтеза требуют соответствующих мер безопасности из-за токсичной и коррозионной природы используемых реагентов. Важно проводить эти реакции в хорошо проветриваемом помещении, носить защитное оборудование и осторожно обращаться с химикатами. Кроме того, следование надлежащим протоколам утилизации отходов имеет важное значение для минимизации воздействия на окружающую среду.
Использование дихромата калия
Бихромат калия находит применение в различных областях благодаря своим уникальным свойствам. Вот некоторые из его распространенных применений:
- Окислитель: В химических реакциях дихромат калия широко используется в качестве сильного окислителя для окисления спиртов до альдегидов или кетонов.
- Лабораторный реагент: Аналитическая химия использует дихромат калия в качестве реагента для тестов и экспериментов, включая определение органических соединений и проведение окислительно-восстановительных реакций.
- Дубильная промышленность. Кожевенная промышленность использует дихромат калия в качестве дубильного вещества для обработки шкур животных и превращения их в прочные кожаные изделия.
- Фотография. В черно-белой фотографии дихромат калия включается в проявляющие растворы и используется для сенсибилизации эмульсий для достижения определенных фотографических эффектов.
- Консервация древесины: Чтобы защитить древесину от гнили, грибков и насекомых, промышленность по консервации древесины использует дихромат калия в качестве высокотоксичного консерванта для древесины.
- Производство пигментов. Дихромат калия играет жизненно важную роль в производстве пигментов, таких как желтый хром и оранжевый хром, которые промышленность использует в красках, чернилах и красителях.
- Гальваника: В процессах гальваники используется дихромат калия для создания декоративного, устойчивого к коррозии покрытия на металлах, включая цинк, алюминий и латунь.
- Пиротехника: Дихромат калия играет важную роль в пиротехнических смесях, придавая ярко-оранжевый цвет фейерверкам и вспышкам.
- Текстильная промышленность: при крашении и печати тканей используется дихромат калия для достижения желаемых цветов и улучшения стойкости цвета.
- Калибровка лабораторной посуды. Для точного измерения объема растворы дихромата калия используются для калибровки лабораторной посуды.
Эти разнообразные применения подчеркивают универсальность и важность дихромата калия в различных отраслях промышленности и научных исследованиях.
Вопросы:
Вопрос: Какова правильная формула дихромата калия?
Ответ: Правильная формула дихромата калия — K2Cr2O7.
Вопрос: Что такое дихромат калия?
Ответ: Дихромат калия представляет собой ярко-оранжевое химическое соединение, которое обычно используется в качестве окислителя.
Вопрос: Дихромат калия ионный или ковалентный?
Ответ: Дихромат калия является ионным соединением.
Вопрос: Какое минимальное количество воды необходимо для растворения 3 молей дихромата калия?
Ответ: Минимальное количество воды, необходимое для растворения 3 молей дихромата калия, составляет примерно 564 грамма.
Вопрос: Какова молярная масса дихромата калия?
A: Молярная масса дихромата калия составляет 294,18 грамма на моль (г/моль).
Вопрос: Паспорт безопасности дихромата калия?
Ответ: В паспортах безопасности материалов (MSDS) дихромата калия содержится подробная информация о его опасностях, обращении, хранении и мерах первой помощи. Пожалуйста, обратитесь к надежным источникам или производителям для получения конкретного паспорта безопасности.
Вопрос: Как получают дихромат калия из хромитовой руды?
Ответ: Бихромат калия можно получить из хромитовой руды путем обжига ее с гидроксидом калия или карбонатом калия и последующего выделения продукта.
Вопрос: Сколько граммов дихромата калия было добавлено в мерную колбу?
Ответ: Точное количество граммов дихромата калия, добавляемого в мерную колбу, зависит от желаемой концентрации и объема раствора.
Вопрос: Как бы вы различили пропаналь и пропанон, используя подкисленный дихромат калия?
Ответ: Пропаналь будет окисляться до пропановой кислоты подкисленным дихроматом калия, тогда как пропанон (ацетон) не вступит в реакцию.
Вопрос: Является ли дихромат калия восстановителем?
Ответ: Нет, дихромат калия является окислителем.
Вопрос: Как написать формулу дихромата калия?
Ответ: Формула дихромата калия: K2Cr2O7.
