Гидроксид бария – химическое соединение формулы Ba(OH)2. Это белое кристаллическое твердое вещество, хорошо растворимое в воде и обычно используемое в лабораториях и промышленных процессах.
| Название ИЮПАК | Дигидроксид бария |
| Молекулярная формула | Ба(ОН)2 |
| Количество CAS | 17194-00-2 |
| Синонимы | Гидроксид бария (II), барит, гидрат бария, дигидрат бария, бис (гидроксид бария), бис (оксиданил) гидрат бария |
| ИнЧИ | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Молярная масса of гидроксид бария
Гидроксид бария имеет молярную массу 171,34 г/моль. Он состоит из одного иона бария (Ba2+) и двух ионов гидроксида (OH-), каждый из которых имеет молярную массу 137,33 г/моль и 17,01 г/моль соответственно. Молярная масса гидроксида бария важна для определения количества соединения, необходимого для реакции, или для расчета концентрации раствора.
Формула гидроксида бария
Химическая формула гидроксида бария: Ba(OH)2. Он состоит из одного иона бария (Ba2+) и двух ионов гидроксида (OH-). Формула гидроксида бария важна для определения количества соединения, необходимого в реакциях, или для расчета концентрации раствора. Он также используется для представления структуры соединения и его поведения в растворе.
Температура кипения Ba(OH)2
Температура кипения Ba(OH)2 точно не определена, поскольку он разлагается до кипения. Ba(OH)2 является сильным основанием и легко реагирует с углекислым газом воздуха, образуя карбонат бария и воду. Температура разложения Ba(OH)2 зависит от концентрации раствора, но обычно превышает 780°C.
Ba(OH)2 температура плавления
Ba(OH)2 имеет температуру плавления 407°C. Он существует в твердом состоянии в виде белых кристаллов без запаха. При нагревании Ba(OH)2 вступает обратимая реакция с образованием оксида бария и воды. Температура плавления Ba(OH)2 важна для определения температуры, при которой с ним можно безопасно обращаться и хранить.
Плотность Ba(OH)2 г/мл
Плотность твердого Ba(OH)2 составляет 3,22 г/см3. В растворе плотность варьируется в зависимости от концентрации. Например, 10% раствор Ba(OH)2 имеет плотность 1,17 г/см3. Плотность Ba(OH)2 важна при определении объема раствора, необходимого для реакций или при работе с соединением.
Молекулярная масса Ba(OH)2
Молекулярная масса Ba(OH)2 составляет 171,34 г/моль. Это сумма атомных весов одного иона бария и двух ионов гидроксида. Молекулярная масса Ba(OH)2 важна для определения количества соединения, необходимого в реакциях, или для расчета концентрации раствора.
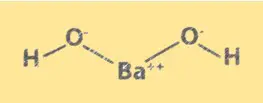
Структура Ba(OH)2
Ba(OH)2 имеет кристаллическую структуру, подобную хлориду натрия. Он состоит из ионов Ba2+ и ионов OH-, расположенных в кубической решетке. Ионы Ba2+ занимают углы куба, а ионы OH- — центр каждой грани. Структура Ba(OH)2 важна для понимания его химических свойств и поведения в растворе.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 3,22 г/см3 (твердый) |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 171,34 г/моль |
| Плотность | 2,18 г/см3 (водный раствор, 10% масс. при 25°C) |
| Точка плавления | 407°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим в воде |
| Растворимость | Растворим в спирте и ацетоне |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Щелочная (pH > 7) |
Примечание. Значения, приведенные в этой таблице, являются общими и могут меняться в зависимости от конкретных условий и концентрации вещества.
Безопасность и опасности гидроксида бария
Ba(OH)2 — высокоедкое и токсичное вещество, способное вызвать сильное раздражение кожи, глаз и дыхательных путей. Важно обращаться с ним осторожно и носить соответствующие средства индивидуальной защиты, такие как перчатки и защитные очки. При вдыхании или проглатывании он может нанести серьезный вред легким, пищеварительной системе и почкам. Его следует хранить в прохладном, сухом, хорошо проветриваемом помещении, вдали от несовместимых материалов, таких как кислоты и окислители. В случае разлива или воздействия следуйте соответствующим аварийным процедурам, например, покиньте помещение и немедленно обратитесь за медицинской помощью.
| Символы опасности | Коррозионный |
| Описание безопасности | Избегайте контакта с кожей и глазами; Носите защитную одежду и перчатки; Использовать только в хорошо проветриваемых помещениях |
| Идентификаторы сети | ООН 1564 |
| код ТН ВЭД | 2816.40.00 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании, вдыхании и попадании через кожу; Вызывает серьезное раздражение кожи и глаз; Может вызвать раздражение дыхательных путей и повреждение почек. |
Методы синтеза гидроксида бария
Ba(OH)2 можно синтезировать несколькими методами, включая реакцию оксида бария (BaO) с водой (H2O) или реакцию хлорида бария (BaCl2) с гидроксидом натрия (NaOH).
В первом методе оксид бария медленно добавляют в дистиллированную воду при постоянном перемешивании до достижения нужной концентрации. Полученный раствор затем фильтруют и сушат с получением твердой формы Ba(OH)2.
Во втором методе раствор хлорида бария медленно добавляют к раствору гидроксида натрия при постоянном перемешивании до достижения желаемого значения pH. Полученный раствор затем фильтруют и сушат с получением твердой формы Ba(OH)2.
Другой метод включает реакцию сульфида бария (BaS) с водой с образованием Ba(OH)2 и газообразного сероводорода (H2S).
Ba(OH)2 также можно получить электролизом расплавленных солей бария или термическим разложением карбоната бария (BaCO3) при высокой температуре.
В целом, синтез Ba(OH)2 требует осторожного обращения и соответствующих мер безопасности из-за его высокой едкости и токсичности. При работе с опасными материалами важно соблюдать соответствующие протоколы и правила техники безопасности.
Использование гидроксида бария
Ba(OH)2 имеет несколько промышленных и лабораторных применений из-за его высокой реакционной способности и щелочных свойств. Одно из его основных применений — использование в качестве химического реагента при производстве различных химикатов, включая смазочные материалы, пластмассы и пестициды.
Ba(OH)2 также используется в качестве стабилизатора в ПВХ и других пластмассах для предотвращения обесцвечивания и разрушения, вызванных нагреванием и воздействием ультрафиолетовых лучей. Он также используется в производстве некоторых типов стекла, таких как оптическое стекло и стекло с высоким показателем преломления.
В лаборатории Ba(OH)2 используется в качестве катализатора в различных органических реакциях, таких как реакции этерификации и переэтерификации. Его также используют как титрант в аналитической химии для определения слабых кислот и при приготовлении стандартных растворов.
Другое применение Ba(OH)2 — производство оксида бария, используемого при производстве электронно-лучевых трубок для телевизоров и компьютерных мониторов.
Ba(OH)2 также используется при очистке промышленных сточных вод для удаления примесей и нейтрализации кислотных или щелочных стоков перед сбросом в окружающую среду.
В целом Ba(OH)2 играет важную роль во многих отраслях промышленности и лабораториях, способствуя производству многих продуктов и процессов.
Вопросы:
Растворим ли гидроксид бария?
Да, гидроксид бария растворим в воде. При растворении в воде образует щелочной раствор с pH примерно 12,5. Растворимость Ba(OH)2 в воде относительно высока: растворимость составляет примерно 3,52 г/100 мл при комнатной температуре (25 °C). На растворимость Ba(OH)2 могут влиять такие факторы, как температура, давление и присутствие других веществ в растворе.
Является ли гидроксид бария сильным основанием?
Да, гидроксид бария является сильным основанием. При растворении в воде он полностью диссоциирует с образованием в растворе ионов бария (Ba2+) и гидроксид-ионов (OH-). В результате этой диссоциации образуется сильнощелочной раствор с pH примерно 12,5. Сильноосновные свойства Ba(OH)2 делают его эффективным нейтрализатором кислых стоков и катализатором различных органических реакций.
Какая формула гидроксида бария?
Формула гидроксида бария Ba(OH)2. Эта формула указывает на то, что каждая молекула гидроксида бария содержит один ион бария (Ba2+) и два иона гидроксида (OH-). Ион бария имеет заряд +2, а ион гидроксида — заряд -1. Два гидроксид-иона в Ba(OH)2 уравновешивают заряд +2 иона бария, образуя нейтральное соединение. Формула Ba(OH)2 важна для понимания его свойств и реакций, а также для расчета его молярной массы и других физико-химических свойств.
