Бромид меди (CuBr2) представляет собой соединение меди и брома. Он имеет сине-зеленый цвет, часто используется в органическом синтезе и в качестве катализатора кислоты Льюиса.
| Название ИЮПАК | Бромид меди(II) |
| Молекулярная формула | CuBr2 |
| Количество CAS | 7789-45-9 |
| Синонимы | Бромид меди, дибромид меди |
| ИнЧИ | ИнЧИ=1S/Br2.Cu |
Свойства бромида меди
Формула бромида меди
Формула бромида меди: CuBr2. Он представляет собой соединение, образованное одним атомом меди и двумя атомами брома. В результате этой комбинации образуется сине-зеленое кристаллическое вещество, обычно используемое в различных химических реакциях.
Бромид меди Молярная масса
Молярная масса бромида меди составляет приблизительно 223,36 грамма на моль. Это значение получается сложением атомных масс одного атома меди (Cu) и двух атомов брома (Br), присутствующих в формуле CuBr2.
Температура кипения бромида меди
Бромид меди имеет температуру кипения около 1294 градусов Цельсия (около 2361 градусов по Фаренгейту). Эта температура указывает точку, в которой вещество переходит из жидкого состояния в газообразное при стандартном атмосферном давлении.
Температура плавления бромида меди
Температура плавления бромида меди составляет около 498 градусов Цельсия (около 928 градусов по Фаренгейту). Эта температура представляет собой точку, в которой твердое вещество переходит в жидкое состояние при нагревании.
Плотность бромида меди г/мл
Плотность бромида меди составляет примерно 4,71 грамма на миллилитр (г/мл) при стандартной комнатной температуре и атмосферном давлении. Это значение показывает количество массы, присутствующей в единице объема вещества.
Бромид меди Молекулярный вес
Бромид меди имеет молекулярную массу примерно 223,36 грамма на моль. Это значение имеет решающее значение для различных химических расчетов и служит ориентиром для определения количества вещества, присутствующего в данном образце.
Структура бромида меди
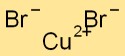
Бромид меди имеет структуру кристаллической решетки, в которой атомы меди окружены атомами брома и наоборот. Такое расположение образует стабильную и упорядоченную структуру, внося вклад в физические свойства соединения.
Растворимость бромида меди
Бромид меди ограниченно растворяется в воде. Он лучше растворяется в органических растворителях. Растворимость зависит от таких факторов, как температура и природа используемого растворителя. Понимание его растворимости жизненно важно для различных применений в химии и промышленности.
| Появление | Сине-зеленые кристаллы |
| Удельный вес | Нет в наличии |
| Цвет | Цвет морской волны |
| Запах | Без запаха |
| Молярная масса | 223,36 г/моль |
| Плотность | 4,71 г/мл |
| Точка плавления | 498°С (928°Ф) |
| Точка кипения | 1294°С (2361°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Ограниченная растворимость |
| Растворимость | Растворим в органических растворителях, таких как этанол, эфир и бензол. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нет в наличии |
Безопасность и опасность бромида меди
Бромид меди представляет определенные соображения безопасности и опасности. Крайне важно обращаться с этим соединением с осторожностью из-за его потенциальной токсичности и раздражающих свойств. Прямой контакт с кожей или глазами может вызвать раздражение и дискомфорт. Вдыхание его пыли или паров может вызвать раздражение дыхательных путей. Поэтому при работе с бромидом меди следует носить соответствующие средства индивидуальной защиты, такие как перчатки и очки. Кроме того, его следует хранить вдали от несовместимых веществ, чтобы избежать возможных реакций. В случае проглатывания или случайного воздействия немедленно обратитесь за медицинской помощью. Соблюдение мер предосторожности имеет решающее значение для обеспечения безопасного обращения и использования бромида меди.
| Символы опасности | Раздражающее, Разъедающее |
| Описание безопасности | Ручка с залогом. Избегайте прямого контакта с кожей и глазами. Используйте соответствующее защитное оборудование. |
| Идентификационные номера ООН | Нет в наличии |
| код ТН ВЭД | Нет в наличии |
| Класс опасности | Раздражающий |
| Группа упаковки | Нет в наличии |
| Токсичность | Может вызвать раздражение кожи и глаз. Вдыхание пыли или паров может вызвать раздражение дыхательных путей. |
Методы синтеза бромида меди
Существует несколько методов синтеза бромида меди (CuBr2). Обычный подход предполагает прямое сочетание металлической меди или оксида меди с бромистоводородной кислотой . В этом методе мы добавляем в кислоту медь, и она вступает в химическую реакцию, в результате которой образуется бромид меди и выделяется газообразный водород.
Другой метод — реакция карбоната или гидроксида меди с бромистоводородной кислотой. Карбонат или гидроксид реагирует с кислотой с образованием бромида меди, воды и углекислого газа.
Кроме того, для синтеза бромида меди можно использовать реакцию двойного замещения. Этот метод включает реакцию между растворимой солью меди, такой как сульфат меди, и растворимой бромистой солью, такой как бромид натрия. Реакция приводит к образованию бромида меди и растворимой соли другого металла или металлоида, присутствующих в реакции.
Кроме того, для синтеза бромида меди можно использовать электрохимические методы. Эти методы предполагают использование электрохимической ячейки с медными электродами и источника бромид-ионов. При подаче тока на одном электроде образуется бромид меди, а на другом выделяется газообразный бром.
Выбор метода синтеза зависит от таких факторов, как доступность реагентов, желаемая чистота и степень реакции. Во время всех синтетических процедур следует соблюдать правильное обращение и меры предосторожности.
Использование бромида меди
Бромид меди (CuBr2) благодаря своим уникальным свойствам находит универсальное применение в различных отраслях промышленности. Вот некоторые из его заметных применений:
- Органический синтез : Бромид меди служит катализатором во многих органических реакциях, таких как реакция Ульмана и реакция Вюрца-Фиттига, позволяя образовывать связи углерод-углерод и углерод-гетероатом.
- Фотография : используется в фотографических процессах для повышения чувствительности эмульсий и улучшения чувствительности пленок и пластин, тем самым облегчая получение изображений высокого качества.
- Гальваника : Бромид меди используется в процессах гальваники для нанесения слоев меди на поверхности, обеспечивая устойчивость к коррозии и декоративную отделку.
- Полупроводниковая промышленность . В секторе электроники он используется при синтезе нанокристаллов на основе бромида меди, которые находят применение в оптоэлектронике и фотонике.
- Пламенный краситель : бромид меди используется в пиротехнике и фейерверках для получения зеленого цвета пламени, придающего визуальную привлекательность дисплеям.
- Медицина : Несмотря на ограниченность, его потенциальное терапевтическое применение исследовалось из-за его антибактериальных свойств.
- Лазерная технология : Лазеры на бромиде меди используются в научных исследованиях, исследованиях лазерно-индуцированной флуоресценции и для генерации лазерных импульсов высокой энергии.
- Химический анализ : используется в аналитической химии для качественного и количественного анализа.
- Реакции бромирования : Бромид меди действует как агент бромирования, облегчая присоединение брома к органическим соединениям.
- Литография : В процессах литографии соединения бромида меди исследовались на предмет использования в методах микро- и нанопроизводства.
Различные применения бромида меди демонстрируют его важность в различных областях, что делает его ценным соединением в промышленных и научных целях.
Вопросы:
Вопрос: Какова молярная масса бромида меди(II)?
A: Молярная масса бромида меди(II) составляет приблизительно 223,36 г/моль.
Вопрос: Какова формула бромида меди (II)?
A: Формула бромида меди(II) — CuBr2.
Вопрос: Растворим ли бромид меди(II) в воде?
A: Бромид меди(II) имеет ограниченную растворимость в воде.
Вопрос: Для чего используется бромид меди (II)?
Ответ: Бромид меди(II) используется в качестве катализатора в органическом синтезе, фотографии, гальванике и полупроводниковой промышленности.
Вопрос: Являются ли бромиды цинка и меди одноразовой заменой?
Ответ: Да, цинк и бромид меди(II) подвергаются единственной реакции замещения, в результате которой образуется бромид цинка и металлическая медь.
Вопрос: Происходит ли реакция при объединении водных растворов ацетата бария и бромида меди(II)?
Ответ: Да, происходит реакция, приводящая к образованию бромида бария и ацетата меди(II).
Вопрос: Какие ионы (если таковые имеются) образуются при добавлении бромида меди(II) в воду?
Ответ: Когда бромид меди(II) добавляется в воду, он диссоциирует на ионы Cu^2+ и ионы бромида (Br^-).
Вопрос: Образует ли CuBr2 ионную связь?
Ответ: Да, CuBr2 образует ионную связь между ионами меди и брома.
Вопрос: Образует ли CuBr2 ковалентную связь?
О: Нет, CuBr2 не образует ковалентной связи.
Вопрос: Растворим ли CuBr2 в воде?
Ответ: CuBr2 имеет ограниченную растворимость в воде.
Вопрос: Что такое CuBr2?
A: CuBr2 — это химическая формула бромида меди(II), сине-зеленого кристаллического соединения.
Вопрос: CuBr2 растворим или нерастворим?
Ответ: CuBr2 плохо растворяется в воде.
Вопрос: Каков массовый процент меди в CuBr2?
Ответ: Массовая доля меди в CuBr2 составляет примерно 47,5%.
