Борат натрия – соединение, используемое в различных отраслях промышленности. Он имеет множество применений: в качестве чистящего средства, флюса в металлургии и компонента косметических и моющих средств.
| Название ИЮПАК | Борат натрия |
| Молекулярная формула | Na2B4O7 |
| Количество CAS | 1330-96-4 |
| Синонимы | Бура, тетраборат натрия, тетраборат динатрия, биборат натрия |
| ИнЧИ | InChI=1S/B4O7.2Na/c5-1-7-3-9-2-8-4-10-3;;/q-2;2*+1 |
Свойства бората натрия
Формула бората натрия
Химическая формула бората натрия: Na2B4H20O17. Он состоит из двух атомов натрия (Na), четырех атомов бора (B) и семи атомов кислорода (O). Формула представляет соотношение каждого элемента в соединении.
Борат натрия Молярная масса
Молярная масса буры рассчитывается путем сложения атомных масс всех атомов соединения. Молярная масса буры составляет приблизительно 381,37 грамма на моль (г/моль). Это полезно для определения количества вещества, присутствующего в данном образце.
Температура кипения бората натрия
Бура имеет относительно высокую температуру кипения. При стандартном атмосферном давлении он кипит примерно при 1,575 градусах Цельсия (С). Высокая температура кипения делает его пригодным для различных промышленных применений, связанных с высокотемпературными процессами.
Борат натрия Температура плавления
Бура имеет температуру плавления около 741 градуса Цельсия (С). При этой температуре происходит фазовый переход из твердого состояния в жидкое. Относительно низкая температура плавления позволяет буре легко плавиться и использоваться в различных производственных процессах.
Плотность бората натрия г/мл
Плотность буры составляет примерно 1,73 грамма на миллилитр (г/мл). Плотность – это мера количества массы, содержащейся в данном объеме. Относительно высокая плотность буры делает ее полезным соединением в тех случаях, когда важен ее вес или концентрация.
Молекулярный вес бората натрия
Молекулярная масса буры составляет примерно 381,37 грамма на моль (г/моль). Он представляет собой сумму атомных весов всех атомов в молекуле буры. Молекулярный вес необходим для различных расчетов, например, для определения количества молей или массы вещества.
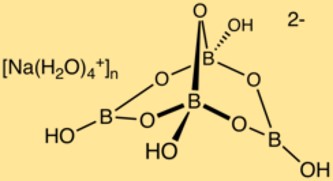
Структура бората натрия
Бура имеет сложную кристаллическую структуру, состоящую из бор-кислородных многогранников и ионов натрия. Атомы бора образуют сеть с атомами кислорода, создавая трехмерную структуру. В этой структуре расположены ионы натрия, обеспечивающие стабильность соединения.
Растворимость бората натрия
Бура умеренно растворима в воде. Он легко растворяется в горячей воде, и его растворимость увеличивается с температурой. Однако его растворимость в органических растворителях ограничена. Растворимость буры делает ее полезной для различных применений, в том числе в качестве чистящего средства и при приготовлении растворов и смесей.
| Появление | Белый кристаллический порошок |
| Удельный вес | 1,73 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 381,37 г/моль |
| Плотность | 1,73 г/мл |
| Точка плавления | 741°С |
| Точка кипения | 1575°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде, ограниченно растворяется в органических растворителях. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Непригодный |
| рН | Около 9 утра-10 утра |
Безопасность и опасность бората натрия
С бурой следует обращаться с осторожностью из-за ее потенциального риска для безопасности. Он может вызвать раздражение кожи, глаз и дыхательной системы при прямом контакте или вдыхании. Проглатывание больших количеств может вызвать расстройство желудочно-кишечного тракта. При работе с бурой следует использовать защитные меры, такие как перчатки и очки, чтобы избежать воздействия. Важно хранить его в безопасном, хорошо проветриваемом помещении, вдали от несовместимых веществ. В случае проглатывания или случайного воздействия следует немедленно обратиться за медицинской помощью. Для получения подробной информации об опасностях буры и мерах предосторожности следует обратиться к соответствующим паспортам безопасности материалов и инструкциям по обращению.
| Символы опасности | Токсичный |
| Описание безопасности | Вред при проглатывании. Вызывает раздражение кожи и глаз. |
| Идентификационные номера ООН | ООН 1458 |
| код ТН ВЭД | 2840.19.20 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | III |
| Токсичность | Умеренная токсичность при проглатывании или попадании на кожу/глаза. |
Методы синтеза бората натрия
Существует несколько методов синтеза буры. Распространенным методом является реакция между бурой (декагидрат тетрабората натрия) и карбонатом натрия . В этом процессе растворите буру в воде, а затем добавьте в раствор карбонат натрия . Происходит реакция с образованием буры и осаждением твердого вещества. Отделите и высушите твердое вещество, чтобы получить буру.
Другой метод — растворить борную кислоту в воде и постепенно добавлять в раствор гидроксид натрия. Происходит реакция и образуется бура. Выпарите раствор, чтобы удалить лишнюю воду и получить кристаллы буры.
Дополнительно смешайте оксид бора с гидроксидом натрия в подходящем растворителе и нагрейте смесь. Происходит реакция и образуется бура. Отфильтруйте смесь, чтобы отделить примеси, и дайте фильтрату остыть и кристаллизоваться, получая буру.
Эти синтетические методы обеспечивают способы контролируемого получения буры. Однако важно соблюдать надлежащие меры предосторожности и ответственно обращаться с химикатами в процессе синтеза.
Использование бората натрия
Бура, также известная как бура, имеет широкий спектр применения в различных отраслях промышленности благодаря своим универсальным свойствам. Вот некоторые из его распространенных применений:
- Флюс в металлургии: он служит флюсом при сварке и пайке, помогая снизить температуру плавления металлов и облегчая течение расплавленного металла.
- Огнезащитный состав: находит применение в качестве антипирена в различных материалах, включая целлюлозную изоляцию, текстиль и изделия из дерева.
- Стекло и керамика: Бура является важным компонентом при производстве стекла и керамики. Это помогает снизить температуру плавления, повысить долговечность и улучшить оптические свойства этих материалов.
- Буфер pH: действует как буфер pH в лабораториях и научных экспериментах.
- Чистящее средство. В бытовых средствах, таких как стиральные порошки, средства для мытья посуды и универсальные чистящие средства, в качестве чистящего средства эффективно используется бура.
- Косметика: В косметике и средствах личной гигиены бура используется в качестве буферного агента, регулятора pH и эмульгатора.
- Консервант: изделия из дерева содержат буру в качестве консерванта для предотвращения заражения грибками и насекомыми.
- Сельское хозяйство: Бура действует как удобрение с микроэлементами, восполняющее дефицит бора в сельскохозяйственных культурах, тем самым способствуя здоровому росту растений.
- Медицинское применение: Лекарственные составы включают буру из-за ее антисептических и вяжущих свойств.
- Очистка воды: в процессах очистки воды используется бура для подавления роста водорослей и контроля уровня pH.
Эти разнообразные применения подчеркивают важность буры в различных отраслях промышленности, что делает ее ценным и универсальным соединением.
Вопросы:
Вопрос: Для чего используется борат натрия?
A: Бура используется в качестве чистящего средства, флюса в металлургии, компонента в косметике, антипирена, в производстве стекла/керамики, в качестве консерванта для древесины и т. д.
Вопрос: Где купить борат натрия?
О: Буру можно приобрести у различных поставщиков химикатов, в хозяйственных магазинах, на интернет-рынках и в некоторых продуктовых магазинах.
Вопрос: Каким будет катион при растворении бората натрия?
Ответ: Катион, выделяющийся при растворении буры, представляет собой натрий (Na+).
Вопрос: Борат натрия — это то же самое, что борная кислота?
Ответ: Нет, бура и борная кислота — это разные соединения, хотя оба они содержат бор.
Вопрос: Борат натрия — это то же самое, что бура?
Ответ: Да, буру обычно называют бурой.
Вопрос: На основе бората натрия?
Ответ: Бура действует как слабое основание в водных растворах.
Вопрос: Можно ли пить борат натрия?
Ответ: Буру нельзя принимать внутрь, так как она может быть токсичной. Он не предназначен для потребления.
Вопрос: Нейтрализует ли борат натрия серную кислоту?
Ответ: Нет, бура не нейтрализует серную кислоту. Он может реагировать, но не полностью нейтрализует его.
Вопрос: Какова функция бората натрия в элюирующем буфере с pH 10?
A: Бура в элюирующем буфере с pH 10 облегчает элюирование отрицательно заряженных биомолекул из хроматографических колонок.
Вопрос: Что такое бура?
Ответ: Бура, также известная как борат натрия, представляет собой природное минеральное соединение, состоящее из молекул натрия, бора, кислорода и воды.
Вопрос: Что произойдет, если буру сильно нагреть?
Ответ: При сильном нагревании буры она подвергается обезвоживанию и теряет молекулы воды, что приводит к образованию безводной буры.
Вопрос: Бура — это то же самое, что борная кислота?
Ответ: Нет, бура и борная кислота — разные соединения. Бура — это борат натрия, а борная кислота — это кислая форма бора.
Вопрос: Что такое порошок буры?
Ответ: Порошок буры относится к порошкообразной форме буры, которая используется для различных целей, таких как уборка, стирка и поделки.
