Бикарбонат лития (LiHCO3) представляет собой химическое соединение, используемое в различных областях. Он обладает щелочными свойствами и используется в исследованиях, фармацевтике и в качестве потенциального средства для лечения определенных заболеваний.
| Название ИЮПАК | Бикарбонат лития |
| Молекулярная формула | LiHCO3 |
| Количество CAS | 5006-97-3 |
| Синонимы | Гидрокарбонат лития, бикарбонат лития |
| ИнЧИ | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Свойства бикарбоната лития
Формула бикарбоната лития
Гидрокарбонат лития имеет химическую формулу LiHCO3. Он состоит из катиона лития (Li), аниона гидрокарбоната (HCO3) и атома водорода (H). Формула отражает наличие в соединении ионов лития и бикарбоната.
бикарбонат лития Молярная масса
Молярная масса гидрокарбоната лития (LiHCO3) составляет примерно 68 граммов на моль (г/моль). Он рассчитывается путем сложения атомных масс составляющих его элементов: лития, водорода, углерода и кислорода.
Температура кипения бикарбоната лития
Гидрокарбонат лития не имеет четко определенной температуры кипения, поскольку он разлагается при высоких температурах. При нагревании он теряет углекислый газ (CO2) и воду (H2O), превращаясь в карбонат лития (Li2CO3).
Бикарбонат лития Температура плавления
Гидрокарбонат лития имеет температуру плавления около 250 градусов по Цельсию (482 градуса по Фаренгейту). При этой температуре происходит фазовый переход из твердого состояния в жидкое.
Плотность бикарбоната лития г/мл
Плотность гидрокарбоната лития (LiHCO3) составляет примерно 2,21 грамма на миллилитр (г/мл). Это относительно плотное соединение из-за присутствия лития и других тяжелых элементов.
Бикарбонат лития Молекулярный вес
Гидрокарбонат лития имеет молекулярную массу примерно 68 г/моль. Молекулярная масса представляет собой сумму атомных масс всех атомов в одной молекуле соединения.
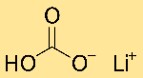
Структура бикарбоната лития
Гидрокарбонат лития имеет кристаллическую структуру. Он образует сеть из атомов лития, гидрокарбоната и водорода, расположенных повторяющимся узором. Структура удерживается ионными и ковалентными связями.
Растворимость бикарбоната лития
Гидрокарбонат лития плохо растворяется в воде. В некоторой степени растворяется в воде, давая слабощелочной раствор. Однако его растворимость относительно низкая по сравнению с другими соединениями лития.
| Появление | Белый кристаллический порошок |
| Удельный вес | ~2,21 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | ~68 г/моль |
| Плотность | ~2,21 г/мл |
| Точка плавления | ~250°С (482°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Мало растворим, образуя слабощелочной раствор. |
| Растворимость | Лимит |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Слегка щелочной |
Безопасность и опасность бикарбоната лития
Гидрокарбонат лития имеет определенные соображения безопасности и опасности. Крайне важно обращаться с составом осторожно, чтобы минимизировать риски. Прямой контакт с кожей или глазами может вызвать раздражение. Следует избегать вдыхания пыли и паров, так как это может вызвать дискомфорт в дыхательных путях. При нагревании разлагается, выделяя углекислый газ и пары воды, которые могут быть потенциально опасны в закрытых помещениях. Кроме того, очень важно правильно хранить гидрокарбонат лития, вдали от несовместимых веществ. При работе с этим составом следует использовать соответствующую вентиляцию и средства индивидуальной защиты, чтобы обеспечить безопасную среду.
| Символы опасности | Нет в наличии |
| Описание безопасности | Обращаться осторожно. Избегать вдыхания, попадания на кожу и в глаза. Храните правильно. Используйте в хорошо вентилируемых помещениях. |
| Идентификационные номера ООН | Нет в наличии |
| код ТН ВЭД | Нет в наличии |
| Класс опасности | Нет в наличии |
| Группа упаковки | Нет в наличии |
| Токсичность | Низкая токсичность; ручка с депозитом. |
Методы синтеза бикарбоната лития
Различные методы позволяют синтезировать гидрокарбонат лития.
Распространенный подход заключается в реакции гидроксида лития (LiOH) с диоксидом углерода (CO2). Реакция протекает в водном растворе, в котором гидроксид лития диссоциирует на ионы лития и гидроксида. Одновременно углекислый газ растворяется в воде, образуя угольную кислоту (H2CO3) . Затем ионы лития реагируют с угольной кислотой с образованием гидрокарбоната лития (LiHCO3) и воды (H2O). Химическое уравнение этой реакции:
LiOH + CO2 → LiHCO3 + H2O
Другой метод включает обработку карбоната лития (Li2CO3) диоксидом углерода в закрытой системе с получением бикарбоната лития. Химическое уравнение этой реакции:
Li2CO3 + CO2 → 2LiHCO3
Эти методы синтеза важны для производства гидрокарбоната лития в лабораторных условиях и для промышленного применения. Крайне важно соблюдать протоколы безопасности и обеспечивать правильное оборудование и условия в процессе синтеза.
Использование бикарбоната лития
Гидрокарбонат лития находит множество применений благодаря своим уникальным свойствам. Вот некоторые из его основных применений:
- Исследования и лаборатории: он служит ценным реагентом в различных химических и исследовательских экспериментах, позволяя ученым изучать химические реакции и свойства.
- Возможное медицинское лечение. В настоящее время проводятся исследования его потенциальной роли в лечении таких заболеваний, как дефицит лития и некоторые заболевания почек, а также в качестве подщелачивающего агента.
- Экологическое применение: он может способствовать удалению углекислого газа из промышленных процессов и имеет потенциальное применение в сокращении выбросов парниковых газов.
- Подщелачивающий агент: в определенных промышленных процессах он действует как подщелачивающий агент, контролируя кислотность и регулируя уровень pH.
- Фармацевтическая промышленность. В фармацевтических препаратах гидрокарбонат лития используется главным образом в лекарствах от расстройств настроения, таких как биполярное расстройство.
- Производство литиевых батарей. Исследователи и экспериментальные круги изучают возможность использования гидрокарбоната лития в современных литиевых батареях для улучшения их характеристик.
- Очистка воды: В процессах очистки воды используется бикарбонат лития для регулирования pH источников воды.
- Сельское хозяйство: гидрокарбонат лития находит ограниченное применение в сельскохозяйственной практике, где фермеры используют его для обработки определенных почвенных условий и улучшения роста растений.
Несмотря на эти области применения, крайне важно обращаться с гидрокарбонатом лития осторожно и соблюдать меры предосторожности, учитывая его потенциальную опасность и реакционную способность. По мере продолжения исследований и технологических достижений могут появиться новые способы применения гидрокарбоната лития, что еще больше повысит его значение в различных областях.
Вопросы:
Вопрос: Какова химическая формула бикарбоната лития?
Ответ: Химическая формула гидрокарбоната лития — LiHCO3.
Вопрос: Может ли бикарбонат лития вызвать низкий уровень витамина D?
Ответ: Нет никаких доказательств того, что гидрокарбонат лития вызывает низкий уровень витамина D.
Вопрос: Что работает лучше: карбонат лития или бикарбонат лития?
Ответ: Эффективность карбоната или бикарбоната лития зависит от их конкретного применения и предполагаемого использования.
Вопрос: Взаимодействует ли бикарбонат лития с экстрактом валерианы?
Ответ: Взаимодействие между гидрокарбонатом лития и экстрактом валерианы не известно, но необходима консультация врача.
Вопрос: Что такое бикарбонат лития?
Ответ: Гидрокарбонат лития представляет собой химическое соединение с щелочными свойствами, используемое в различных областях, включая исследования и фармацевтику.
Вопрос: Можно ли нагревать бикарбонат и карбонат лития в воде?
Ответ: Гидрокарбонат лития и карбонат лития можно нагревать в воде, но они распадаются с образованием других соединений.
Вопрос: Какова потеря веса при расщеплении 3,45 г LiHCO3?
Ответ: Потеря веса при разложении 3,45 г LiHCO3 будет зависеть от конкретной реакции и образующихся продуктов.
Вопрос: Является ли LiHCO3 сильным электролитом?
О: Нет, гидрокарбонат лития (LiHCO3) является слабым электролитом.
Вопрос: Какая соль образуется при реакции H2SO4 с LiHCO3?
Ответ: В результате реакции между H2SO4 и LiHCO3 образуется сульфат лития (Li2SO4), углекислый газ (CO2) и вода (H2O).
Вопрос: LiHCO3 — это кислота или основание?
Ответ: Гидрокарбонат лития (LiHCO3) действует как основание благодаря своим щелочным свойствам.
Вопрос: Реагирует ли N-метилэтанамин с LiHCO3?
Ответ: Реакционная способность N-метилэтанамина с LiHCO3 будет зависеть от конкретных условий реакции и желаемых продуктов.
