Ацетат-ион (C2H3O2-) — это анион, состоящий из одного атома углерода, двух атомов водорода и одного атома кислорода, широко присутствующий в органической химии и биохимии.
| Название ИЮПАК | Этаноат |
| Молекулярная формула | C2H3O2- |
| Количество CAS | 127-09-3 |
| Синонимы | Анион уксусной кислоты; анион этановой кислоты; Ацетат-анион |
| ИнЧИ | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
Ацетатный наполнитель
Ацетат-ион является анионом, что означает, что он несет отрицательный заряд. Ацетат-ион получается из уксусной кислоты , которая представляет собой слабую органическую кислоту, диссоциирующую в воде с образованием ионов водорода (H+) и ацетат-ионов (C2H3O2-). Ацетат-ион имеет заряд -1 и является обычным ионом в биологических системах и во многих химических реакциях.
Ацетатная формула
Ацетат-ион имеет химическую формулу C2H3O2-. Это отрицательно заряженный ион, состоящий из двух атомов углерода, трех атомов водорода и двух атомов кислорода. Ацетат-ион представляет собой сопряженное основание уксусной кислоты , имеющее химическую формулу CH3COOH. Ион ацетата образует соли с положительно заряженными ионами, такими как натрий (Na+) и кальций (Ca2+), с образованием ацетата натрия (CH3COO-Na+) и ацетата кальция (CH3COO-Ca2+) соответственно. ).
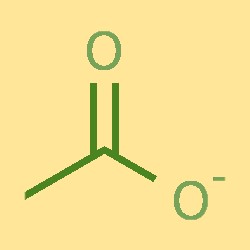
Структура ацетат-ионов
Ацетат-ион состоит из одного атома углерода, двух атомов водорода и одного атома кислорода. Атом углерода связан с одним атомом кислорода и двумя атомами водорода, образуя структуру COH. Атом кислорода также связан с отрицательно заряженным ионом. Ацетат-ион имеет плоскую тригональную форму с валентными углами примерно 120°.
Ацетат-ион Молярная масса
Молярная масса ацетат-иона (C2H3O2) составляет 59,04 г/моль. Он рассчитывается путем сложения атомных весов всех атомов иона. Молярная масса важна для определения количества вещества, присутствующего в образце.
Температура кипения ацетат-ионов
Температура кипения ацетат-иона неприменима, поскольку это отрицательно заряженный ион и не существует как отдельная молекула. Однако температура кипения уксусной кислоты, содержащей ион ацетата, составляет 118,1°С.
Ацетат-ион Молекулярный вес
Молекулярная масса ацетат-иона (C2H3O2) составляет 59,04 г/моль и представляет собой сумму атомных масс всех атомов иона. Молекулярная масса полезна для определения количества вещества в образце.
| Появление | Не применимо (ион) |
| Удельный вес | Не применимо (ион) |
| Цвет | Не применимо (ион) |
| Запах | Не применимо (ион) |
| Молярная масса | 59,04 г/моль |
| Плотность | Не применимо (ион) |
| Точка плавления | Не применимо (ион) |
| Точка кипения | Не применимо (ион) |
| Мигающая точка | Не применимо (ион) |
| Растворимость в воде | Растворим в воде |
| Растворимость | Растворим в воде и полярных растворителях. |
| Давление газа | Не применимо (ион) |
| Плотность пара | Не применимо (ион) |
| пКа | 4,76 |
| рН | Кислота |
Безопасность и опасность ацетат-ионов
Ацетат-ион обычно считается безопасным, поскольку он встречается в природе во многих продуктах питания и напитках. Однако концентрированные растворы уксусной кислоты , содержащие ион ацетата, могут быть вредными при проглатывании, вдыхании или попадании на кожу и в глаза, вызывая раздражение или химические ожоги. При работе с концентрированными растворами уксусной кислоты следует использовать соответствующее защитное оборудование и вентиляцию.
| Символы опасности | Раздражающий |
| Описание безопасности | S2 – Хранить в недоступном для детей месте. S26 – При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. S37 – Наденьте подходящие перчатки. S60 – Этот материал и его контейнер следует утилизировать как опасные отходы. |
| Идентификационные номера ООН | ООН2790 |
| код ТН ВЭД | 2915.90.90 |
| Класс опасности | 8 |
| Группа упаковки | III |
| Токсичность | Ион ацетата считается умеренно токсичным при проглатывании, но концентрированные растворы уксусной кислоты (содержащие ионы ацетата) могут быть вредными при проглатывании, вдыхании или попадании на кожу и в глаза. |
Методы синтеза ацетат-ионов
Синтез ацетат-иона обычно включает образование уксусной кислоты , которая является исходным соединением, содержащим ацетат-ион. Обычный метод синтеза уксусной кислоты включает окисление этанола с использованием окислителя, такого как хромовая кислота. Другой метод включает карбонилирование метанола с использованием монооксида углерода и катализатора. Уксусная кислота также может быть получена биологически путем ферментации углеводов ацетогенными бактериями. Ацетат-ион также можно получить диссоциацией уксусной кислоты в растворе, при которой высвобождаются ацетат-ион и ионы водорода. В некоторых случаях ацетат-ион можно получить также реакцией уксусного эфира с сильным основанием.
Использование ацетат-ионов
Ацетат-ион (C2H3O2) в форме уксусной кислоты служит различным целям во всех отраслях промышленности. В пищевой промышленности уксусная кислота используется в качестве приправы и консерванта из-за ее кислого вкуса и антимикробных свойств. Текстильная промышленность использует уксусную кислоту в качестве компонента кондиционеров для белья и в качестве фиксатора красителей. В химической промышленности уксусная кислота служит сырьем для производства других химикатов, таких как винилацетат, используемых в клеях и покрытиях. Фармацевтическая промышленность использует ацетат-ионы в качестве ингредиента в лекарствах и в качестве буфера при лечении. Кроме того, ацетат целлюлозы, разновидность пластика, производится из уксусной кислоты и находит применение в пленках и оптических волокнах.
