Амид натрия (NaNH2) – химическое соединение. Он состоит из атомов натрия и азота. Он используется в качестве сильного основания в различных химических реакциях.
| Название ИЮПАК | Амид натрия |
| Молекулярная формула | NaNH2 |
| Количество CAS | 7782-92-5 |
| Синонимы | Содамид, азанид натрия, амид натрия, нитрид натрия |
| ИнЧИ | ИнЧИ=1S/NaN2/c2-1-3/q-1 |
Свойства амида натрия
Формула амида натрия
Формула амида натрия: NaNH2. Он состоит из атома натрия (Na), атома водорода (H) и атома азота (N). Эта химическая формула представляет состав амида натрия на молекулярном уровне.
амид натрия Молярная масса
Молярную массу азанида натрия рассчитывают путем сложения атомных масс составляющих его элементов. Атомная масса натрия составляет 22,99 грамма на моль (г/моль), а атомная масса азота — 14,01 г/моль. Сложив эти значения, мы видим, что молярная масса азанида натрия составляет примерно 39 г/моль.
Температура кипения амида натрия
Точка кипения азанида натрия — это температура, при которой он переходит из жидкого состояния в газообразное. Азанид натрия имеет относительно высокую температуру кипения — около 850 градусов Цельсия (°C). При этой температуре преодолеваются межмолекулярные силы, удерживающие молекулы азанида натрия вместе, что приводит к переходу из жидкого состояния в газообразное.
Амид натрия Температура плавления
Точка плавления азанида натрия — это температура, при которой он переходит из твердого состояния в жидкость. Азанид натрия имеет относительно низкую температуру плавления — около 210 градусов Цельсия (°C). При этой температуре структура кристаллической решетки твердого азанида натрия разрушается, позволяя частицам свободно перемещаться, образуя жидкость.
Плотность амида натрия г/мл
Плотность азанида натрия является мерой его массы в единице объема. Плотность азанида натрия составляет примерно 1,39 грамма на миллилитр (г/мл). Это значение указывает на то, что азанид натрия является относительно плотным веществом.
Амид натрия Молекулярный вес
Молекулярная масса азанида натрия представляет собой сумму атомных весов всех атомов в его химической формуле. Молекулярная масса азанида натрия составляет примерно 39 граммов на моль (г/моль).
Структура амида натрия
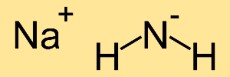
Структура азанида натрия состоит из одного атома натрия (Na), связанного с двумя атомами азота (N). Атомы азота образуют линейное расположение с атомом натрия посередине, что приводит к линейной молекулярной структуре.
Растворимость амида натрия
Азанид натрия плохо растворяется в воде. Реагирует с водой с образованием гидроксида натрия (NaOH) и аммиака (NH3). Однако он растворим в некоторых органических растворителях, таких как жидкий аммиак и жидкие спирты. Растворимость азанида натрия в этих растворителях позволяет использовать его в различных химических реакциях.
| Появление | Белый твердый |
| Удельный вес | 1,39 г/мл |
| Цвет | Белый |
| Запах | Похоже на аммиак |
| Молярная масса | 39 г/моль |
| Плотность | 1,39 г/мл |
| Точка плавления | 210°С |
| Точка кипения | 850°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует |
| Растворимость | Растворим в органических растворителях, таких как жидкий аммиак и жидкие спирты. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Щелочная (выше 7) |
Безопасность и опасность амида натрия
Азанид натрия представляет определенные риски и опасности для безопасности, которые необходимо учитывать. Он бурно реагирует с водой, выделяя токсичный газообразный аммиак и едкий гидроксид натрия. Поэтому с ним следует обращаться с особой осторожностью, чтобы избежать контакта с влагой или водой. Азанид натрия также является сильным основанием, которое может вызвать серьезные ожоги и повреждения глаз при попадании на кожу или в глаза. Вдыхание его пыли или паров может вызвать раздражение дыхательной системы. При работе с азанидом натрия рекомендуется носить соответствующие средства защиты, такие как перчатки, очки и респиратор. Соответствующая вентиляция и хранение вдали от несовместимых веществ являются важными мерами безопасности.
| Символы опасности | Коррозионный, вредный, токсичный |
| Описание безопасности | Обращайтесь с особой осторожностью. Избегайте контакта с водой/влагой. Носите защитное снаряжение. Требуется соответствующая вентиляция и хранение. |
| Идентификационные номера ООН | ООН 1410 |
| код ТН ВЭД | 28500020 |
| Класс опасности | 4.3 (Опасно во влажном состоянии), 6.1 (Токсично), 8 (Коррозионное вещество) |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании, вдыхании или контакте с кожей/глазами. |
Методы синтеза амида натрия
Существуют различные методы синтеза азанида натрия.
Распространенным методом является реакция между металлическим натрием и газообразным аммиаком (NH3) . В этом процессе металлический натрий реагирует с газообразным аммиаком в контролируемых условиях с образованием азанида натрия. Реакция обычно протекает в корпусе реактора, оборудованном соответствующими мерами безопасности.
Другой метод включает реакцию между гидридом натрия (NaH) и газообразным аммиаком . Гидрид натрия, твердое соединение, реагирует с газообразным аммиаком с образованием азанида натрия и газообразного водорода. Для проведения этой реакции часто используют инертную атмосферу, чтобы избежать нежелательных побочных реакций.
Кроме того, реакция между металлическим натрием и жидким аммиаком позволяет получить азанид натрия. Этот метод включает растворение металлического натрия в жидком аммиаке , в результате чего образуются азанид натрия и газообразный водород.
Для синтеза азанида натрия азид натрия (NaN3) реагирует с гидроксидом натрия (NaOH). Реакция между этими двумя соединениями приводит к образованию азанида натрия, а также к выделению газообразного азота.
Следует отметить, что эти синтетические методы требуют опыта и соответствующих мер безопасности из-за реакционной способности и опасностей, связанных с азанидом натрия.
Использование амида натрия
Азанид натрия благодаря своим уникальным свойствам находит применение в различных областях. Вот некоторые из его применений:
- Сильное основание в реакциях органической химии: азанид натрия депротонирует слабые кислоты, облегчая синтез различных органических соединений.
- Источник азота в реакциях: Азанид натрия вводит атомы азота в органические молекулы, играя решающую роль в синтезе фармацевтических препаратов, красителей и полимеров.
- Дегидрогалогенирование: азанид натрия удаляет галогениды водорода из органических соединений в реакциях дегидрогалогенирования. Этот процесс облегчает получение алкенов, алкинов и других ненасыщенных соединений.
- Реакции раскрытия цикла: азанид натрия участвует в реакциях раскрытия цикла циклических соединений, таких как синтез Габриэля, превращая циклические амины в первичные амины.
- Десульфуризация: азанид натрия может удалять атомы серы из органических соединений, обеспечивая реакции десульфурации. Это полезно при производстве топлива, не содержащего серы, и для снижения воздействия серосодержащих соединений на окружающую среду.
- Хранение водорода: исследователи исследовали потенциальное использование азанида натрия в системах хранения водорода. Он может реагировать с газообразным водородом, образуя гидрид натрия, который затем может выделять водород при нагревании.
- Поддержка катализатора. Азанид натрия может выступать в качестве носителя катализатора, улучшая эффективность некоторых каталитических реакций. Обеспечивает стабильность и повышает эффективность катализаторов в различных химических превращениях.
В целом, разнообразные свойства азанида натрия делают его ценным соединением в органическом синтезе, химии азота и других промышленных применениях.
Вопросы:
Вопрос: Что делает NaNH2?
Ответ: NaNH2 — сильное основание, обычно используемое в реакциях органической химии для депротонирования слабых кислот и облегчения различных превращений.
Вопрос: Что такое NaNH2?
Ответ: NaNH2 — это амид натрия, химическое соединение, состоящее из ионов натрия (Na) и азанида (NH2), часто используемое в качестве реагента и сильного основания в органическом синтезе.
Вопрос: Для чего используется избыток NaNH2?
Ответ: Избыток NaNH2 может привести к дополнительному депротонированию кислых атомов водорода в реакции, тем самым увеличивая степень депротонирования и потенциально изменяя результат реакции.
Вопрос: Что делает NaNH2 с алкеном?
Ответ: NaNH2 может экстрагировать атом водорода из алкена, что приводит к образованию алкана и соединения алкоксида натрия.
Вопрос: Что делает NaNH2 с бромбензолом?
Ответ: NaNH2 может заменить атом брома в бромбензоле посредством реакции нуклеофильного замещения, что приводит к образованию фениламина натрия.
Вопрос: Является ли NaNH2 сильным основанием?
О: Да, NaNH2 — сильное основание, способное принимать протоны и депротонировать слабые кислоты благодаря наличию амид-иона.
Вопрос: Какая реакция произойдет, если к смеси NaNH2/NH3 добавить H2O?
Ответ: Добавление H2O к смеси NaNH2/NH3 приводит к образованию газообразного аммиака (NH3) и гидроксида натрия (NaOH) в результате реакции между водой и сильным основанием NaNH2.
Вопрос: Какой интермедиат участвует в этой реакции: NaNH2 + жидкий NH3?
Ответ: Промежуточным продуктом, участвующим в реакции NaNH2 с жидким NH3, является сольватированный электрон, образующийся в результате передачи электрона от натрия аммиаку.
Вопрос: Является ли NaNH2 хорошим нуклеофилом?
Ответ: Да, NaNH2 может действовать как хороший нуклеофил благодаря своей способности отдавать электронную пару и участвовать в реакциях нуклеофильного замещения.
Вопрос: Является ли NaNH2 ионным или ковалентным?
Ответ: NaNH2 представляет собой ионное соединение, состоящее из положительно заряженных ионов натрия (Na+) и отрицательно заряженных ионов амида (NH2-).
Вопрос: Будет ли 2-гексин реагировать с амидом натрия?
Ответ: Да, 2-гексин может реагировать с амидом натрия, приводя к образованию ацетилида натрия и соответствующего алкинового соединения.
Вопрос: Какое основание является самым сильным среди амида натрия и феноксата натрия?
Ответ: Азанид натрия является более сильным основанием, чем феноксат натрия, из-за большей основности амид-иона (NH2-) по сравнению с фенокс-ионом (C6H5O-).
