Азотная кислота (HNO3) – сильная и высокореактивная неорганическая кислота. Он используется в удобрениях, взрывчатых веществах, а также в текстильной красильной и полиграфической промышленности. Он также образует нитраты, которые играют важную роль в биологических процессах и реакциях горения.
| Название ИЮПАК | Азотная кислота |
| Молекулярная формула | HNO3 |
| Количество CAS | 7697-37-2 |
| Синонимы | Аква фортис, Селитровый спирт, Азотистая кислота |
| ИнЧИ | ИнХИ=1S/HNO3/c2-1(3)4 |
Свойства азотной кислоты
Молярная масса азотной кислоты
Молярная масса азотной кислоты составляет 63,01 г/моль. Это количество вещества, которое содержит такое же количество объектов (таких как атомы, молекулы или ионы), что и в 12 граммах чистого углерода-12.
Формула азотной кислоты
Химическая формула азотной кислоты: HNO<sub>3</sub>. Он представляет количество и тип атомов в молекуле. Формулу можно использовать для прогнозирования его физических и химических свойств, таких как температура кипения, температура плавления и плотность.
Температура кипения азотной кислоты
Температура кипения азотной кислоты составляет 83,0°C (181,4°F). Это температура, при которой вещество переходит из жидкости в газ при данном давлении. Азотная кислота является высокореактивным и летучим веществом, и температура кипения помогает определить условия, при которых с ней следует обращаться и хранить.
Температура плавления азотной кислоты
Температура плавления азотной кислоты составляет -41,5°C (-42,7°F). Это температура, при которой твердое вещество переходит в жидкое состояние. Низкая температура плавления азотной кислоты позволяет легко обращаться с ней в жидкой форме.
Плотность азотной кислоты г/мл
Плотность азотной кислоты составляет 1,51 г/мл. Это мера количества массы в единице объема вещества. Плотность азотной кислоты может помочь определить требования к ее хранению и обращению, а также ее способность вступать в реакцию с другими веществами.
Молекулярный вес азотной кислоты
Молекулярная масса азотной кислоты составляет 63,01 г/моль. Это сумма атомных весов отдельных атомов молекулы. Молекулярная масса азотной кислоты является важным фактором, определяющим ее физические и химические свойства.
Структура азотной кислоты
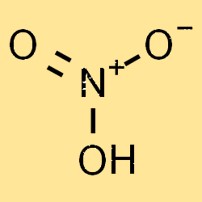
Азотная кислота — бесцветная, высокореактивная и летучая жидкость. Его молекулярная структура состоит из одного атома азота, одного атома водорода и трех атомов кислорода, образующих химическую формулу HNO3. Атомы кислорода расположены плоско-тригонально вокруг атома азота.
| Появление | Бесцветная жидкость |
| Удельный вес | 1,51 г/мл |
| Цвет | Бесцветный |
| Запах | Резкий, резкий запах |
| Молярная масса | 63,01 г/моль |
| Плотность | 1,51 г/мл |
| Точка плавления | -41,5°C (-42,7°F) |
| Точка кипения | 83,0°С (181,4°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | смешивается |
| Растворимость | Растворим в спирте, эфире и других полярных растворителях. |
| Давление газа | Поднятый при комнатной температуре |
| Плотность пара | 1,48 (воздух = 1) |
| пКа | -1,3 |
| рН | 1 (10% раствор) |
Примечание. Температура вспышки азотной кислоты неприменима, поскольку она представляет собой жидкость. pH 10%-ного раствора азотной кислоты равен 1, что указывает на то, что это сильная кислота. pKa — это отрицательный логарифм константы диссоциации кислоты, которая является мерой силы кислоты в растворе.
Безопасность и вред азотной кислоты
Азотная кислота — высокореактивное и коррозийное вещество, которое при неправильном обращении может привести к серьезным травмам или смерти. Это может вызвать ожоги, повреждение глаз и раздражение дыхательных путей. При работе с азотной кислотой следует надевать соответствующее защитное оборудование, такое как перчатки и очки. Помещения для хранения должны хорошо вентилироваться, а разливы следует оперативно убирать, чтобы предотвратить выброс токсичных паров. В случае попадания на кожу или в глаза промойте пораженный участок водой в течение не менее 20 минут и немедленно обратитесь за медицинской помощью.
| Символы опасности | Опасно для окружающей среды, Окисляющее, Вредное, Раздражающее. |
| Описание безопасности | S2 – Хранить в недоступном для детей месте. S23 – Не вдыхать пары. S24/25 – Избегайте попадания на кожу и в глаза. S26 – При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. |
| Идентификационные номера ООН | ООН 2031 |
| код ТН ВЭД | 2811.90.90 |
| Класс опасности | 8 |
| Группа упаковки | III |
| Токсичность | Очень токсичен при проглатывании и вдыхании. Может вызвать серьезные ожоги и повреждения глаз, а также раздражение дыхательных путей. |
Методы синтеза азотной кислоты
Азотную кислоту можно синтезировать несколькими методами, в том числе:
- Процесс Оствальда: Этот метод включает окисление аммиака воздухом с образованием оксида азота, который затем окисляется до азотной кислоты.
- Нитрование толуола. Этот метод включает нитрование толуола с образованием нитротолуола, который затем окисляется с образованием азотной кислоты.
- Термическое разложение нитрата аммония. Этот метод включает нагревание нитрата аммония с образованием оксида азота, который затем окисляется с образованием азотной кислоты.
- Прямое окисление аммиака . Этот метод включает прямое окисление аммиака кислородом с образованием азотной кислоты.
- Электролиз нитрата натрия. Этот метод включает электролиз нитрата натрия с получением азотной кислоты.
Эти методы различаются по эффективности, стоимости и воздействию на окружающую среду, а выбор метода зависит от желаемого конечного использования и масштаба производства.
Использование азотной кислоты
Азотная кислота имеет широкий спектр применения в различных отраслях промышленности, в том числе:
- Удобрение: Азотная кислота используется при производстве азотных удобрений, таких как нитрат аммония и соли азотной кислоты.
- Фармацевтика: Азотная кислота используется в качестве реагента при производстве фармацевтических препаратов и других химических промежуточных продуктов.
- Взрывчатые вещества: Азотная кислота используется при производстве взрывчатых веществ, таких как динамит и нитроцеллюлоза.
- Обработка металлов: Азотная кислота используется для травления, очистки и травления металлов, включая сталь, медь и алюминий.
- Крашение и печать: используется в качестве протравы в процессах крашения и печати.
- Очистка воды: Азотная кислота используется при очистке воды для контроля уровня pH и удаления примесей.
- Исследования и разработки: Азотная кислота используется в качестве лабораторного реагента для различных химических реакций и анализов.
В целом, азотная кислота имеет широкий спектр применения благодаря своим кислотным и окислительным свойствам, что делает ее важным химическим веществом в различных промышленных процессах.
Вопросы:
Азотная кислота – сильная или слабая кислота?
Да, азотная кислота (HNO3) считается сильной кислотой. Сильные кислоты полностью диссоциируют в воде с образованием ионов водорода (H+), то есть полностью ионизируются. Напротив, слабые кислоты ионизируются в воде лишь частично, то есть не диссоциируют полностью.
В растворе азотной кислоты почти каждая молекула отдает ион водорода, что делает ее мощным донором протонов. В результате азотная кислота имеет высокую концентрацию ионов водорода и низкий pH, обычно около 1-2. Сила кислоты определяется ее способностью отдавать ионы водорода, а азотная кислота является одной из самых сильных кислот в списке сильных кислот.
Обратите внимание, что азотная кислота (HNO3) обладает сильным окислительным действием и представляет опасность серьезных ожогов и химических реакций. Обращайтесь с азотной кислотой осторожно и надевайте соответствующие средства защиты.
