Гидразойная кислота (HN3) — легколетучее соединение. Он бесцветен и имеет резкий запах. Он используется в химических реакциях и может быть токсичным и взрывоопасным.
| Название ИЮПАК | Гидрозойная кислота |
| Молекулярная формула | ХН3 |
| Количество CAS | 7782-79-8 |
| Синонимы | Азоимид, азид водорода, азотистая кислота, азотистоводородная кислота, триазойная кислота |
| ИнЧИ | ИнЧИ=1S/HN3/c1-3-2/h1H |
Свойства азотистой кислоты
Формула гидразойной кислоты
Химическая формула азотистоводородной кислоты: HN3. Он состоит из одного атома водорода и трех атомов азота, связанных между собой ковалентно. Эта простая формула представляет основной состав соединения, который имеет решающее значение для понимания его свойств и реакций.
Молярная масса гидразойной кислоты
Молярная масса азида водорода (HN3) составляет примерно 43,03 грамма на моль. Это значение получается сложением атомных масс одного атома водорода (H) и трех атомов азота (N). Молярная масса важна для расчета стехиометрии в химических реакциях.
Температура кипения азотистоводородной кислоты
Азид водорода имеет относительно низкую температуру кипения, около 37 градусов Цельсия (98,6 градусов по Фаренгейту). Из-за своей летучей природы он легко испаряется в газообразную форму при умеренных температурах. При обращении с этим соединением требуется крайняя осторожность.
Гидрозойная кислота Точка плавления
Температура плавления азида водорода составляет около -80 градусов по Цельсию (-112 градусов по Фаренгейту). При этой температуре твердое соединение переходит в жидкую форму. Будучи очень реактивным, его твердое состояние требует надлежащего хранения и обращения.
Плотность азотистоводородной кислоты г/мл
Плотность азида водорода составляет примерно 1,09 грамма на миллилитр. Эта величина указывает на его массу единицы объема, отражающую его компактность и концентрацию в данном пространстве. Это критический параметр для лабораторных измерений.
Гидрозойная кислота Молекулярный вес
Молекулярная масса азида водорода (HN3) составляет 43,03 грамма на моль. Это сумма атомных масс элементов, присутствующих в одной молекуле соединения. Молекулярный вес играет жизненно важную роль в определении его физического и химического поведения.
Строение азотистой кислоты
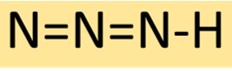
Азид водорода имеет линейную молекулярную структуру, состоящую из трех атомов азота, связанных последовательно, с одним атомом водорода на конце. Такое расположение приводит к получению стабильного, но высокореактивного соединения, часто используемого в химическом синтезе.
Растворимость азотистоводородной кислоты
Азид водорода имеет ограниченную растворимость в воде, что делает его плохо растворимым соединением. Он может растворяться в небольшой степени в водных растворах, но его низкая растворимость ограничивает его использование в некоторых приложениях. При обращении с его водной формой необходима особая осторожность из-за его токсичности и взрывоопасности.
| Появление | Бесцветная жидкость |
| Удельный вес | 1,09 г/мл |
| Цвет | Бесцветный |
| Запах | Резкий запах |
| Молярная масса | 43,03 г/моль |
| Плотность | 1,09 г/мл |
| Точка плавления | -80°С (-112°Ф) |
| Точка кипения | 37°С (98,6°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Слегка растворим |
| Растворимость | Растворим в щелочных и органических растворителях, таких как спирт, эфир. |
| Давление газа | 23,1 мм рт.ст. при 20°C |
| Плотность пара | 1,4 (воздух = 1) |
| пКа | 4.6 |
| рН | Около 3-4 |
Безопасность и опасность гидразойной кислоты
Азид водорода представляет значительную угрозу безопасности. Он очень токсичен и при воздействии может вызвать серьезные последствия для здоровья. Вдыхание его паров или тумана может вызвать раздражение дыхательных путей, головокружение и даже смерть. Контакт с кожей или глазами может вызвать ожоги, раздражение и повреждение тканей. Соединение также чрезвычайно огнеопасно и может образовывать взрывоопасные смеси. Он бурно реагирует с различными веществами, такими как металлы и окислители. При обращении с азидом водорода следует соблюдать соответствующие меры безопасности, в том числе носить защитную одежду, использовать достаточную вентиляцию и надежно хранить его во избежание несчастных случаев или выбросов в окружающую среду. окружающая среда.
| Символы опасности | Череп и скрещенные кости, Едкие |
| Описание безопасности | Очень токсичен, едкий |
| Идентификационные номера ООН | ООН1687 |
| код ТН ВЭД | 2811.29.10 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II (Средняя опасность) |
| Токсичность | Очень токсичен; может быть смертельным в небольших количествах |
Методы синтеза азотистоводородной кислоты
Различные методы позволяют синтезировать азид водорода.
Обычный подход включает реакцию между азидом натрия (NaN3) и кислотой, например серной кислотой (H2SO4) или соляной кислотой (HCl) . В этом методе кислота смешивается с азидом натрия, в результате чего образуется азид водорода и соответствующая соль используемой кислоты.
Другой метод включает реакцию между азидом натрия и алкилгалогенидом, таким как метилиодид (CH3I) или этилиодид (C2H5I). Эта реакция, известная как перегруппировка Курциуса, приводит к образованию азида водорода в качестве продукта.
Реакция между азидом натрия и азотистой кислотой (HNO2) приводит к образованию азида водорода. Для получения азотистой кислоты на месте к кислому раствору обычно добавляют нитрит натрия (NaNO2). Реакция азида натрия с азотистой кислотой приводит к образованию азида водорода.
Важно отметить, что синтез азида водорода требует осторожного обращения и соответствующих мер безопасности. Из-за его токсичности и взрывоопасности реакции следует проводить в хорошо проветриваемом помещении, используя соответствующее защитное оборудование и следуя установленным протоколам.
Каждый метод синтеза имеет свои преимущества и ограничения, и выбор метода зависит от таких факторов, как доступность реагента, желаемый выход и соображения безопасности. Хорошее понимание и опыт обращения с опасными химическими веществами необходимы для эффективного и безопасного проведения такого синтеза.
Использование гидразойной кислоты
Азид водорода находит применение в различных областях благодаря своим уникальным свойствам. Вот некоторые из его применений:
- Химический реагент: Азид водорода служит универсальным химическим реагентом в органическом синтезе, активно участвуя во многих реакциях, включая синтез азидов, которые являются важнейшими строительными блоками фармацевтических препаратов и красителей.
- Детонаторы и порох: Производители используют азид водорода для производства детонаторов и пороха, используемых в подушках безопасности и устройствах безопасности, пользуясь его взрывчатым характером и быстрым разложением, при котором активно выделяется газообразный азот, что делает его ценным в этих применениях.
- Лабораторный анализ: Аналитическая химия использует азид водорода для активного обнаружения и определения различных элементов и соединений. Он активно образует комплексы со специфическими металлами, что позволяет их количественно определять колориметрическими методами или методами титрования.
- Биохимические исследования. В биохимических исследованиях ученые активно используют азид водорода для модификации биомолекул и изучения их функций. Он избирательно реагирует с определенными функциональными группами, тем самым активно способствуя идентификации и характеристике биологических молекул.
- Фотография. В традиционной черно-белой фотографии азид водорода активно действует как сенсибилизатор в эмульсиях, улучшая светочувствительность фотопленок и активно приводя к улучшению качества изображения.
- Ингибитор коррозии. Промышленность активно использует азид водорода в качестве ингибитора коррозии металлов, особенно меди и ее сплавов. Он активно образует на поверхности металла защитный слой, активно предотвращая коррозию и продлевая срок службы различного оборудования и конструкций.
- Газогенераторы: Азид водорода активно используется в газогенераторах для подушек безопасности и спасательных систем. Его быстрое разложение активно выделяет газообразный азот, обеспечивая силу, необходимую для надувания и развертывания.
Вопросы:
Вопрос: Является ли азотистая кислота едкой?
О: Да, азотистоводородная кислота считается едкой и при контакте может вызвать ожоги и повреждение тканей.
Вопрос: Является ли азотистоводородная кислота сильной кислотой?
Ответ: Да, азотистоводородная кислота классифицируется как сильная кислота, способная полностью ионизироваться в воде с выделением ионов гидроксония.
Вопрос: Является ли азотистоводородная кислота тройной кислотой?
Ответ: Нет, азотистоводородная кислота не является тройной кислотой. Тройные кислоты содержат три разных элемента (водород, кислород и третий элемент), тогда как азотистоводородная кислота содержит только водород, азот и кислород.
Вопрос: Сколько мл азотистоводородной кислоты на 12,5 мл?
Ответ: Вопрос кажется неполным и для точного ответа требует дополнительной информации.
Вопрос: Какова правильная структура Льюиса для азотистоводородной кислоты (HN3), включая формальные заряды, если таковые имеются?
Ответ: Правильная структура Льюиса для HN3 состоит из центрального атома азота, связанного с тремя другими атомами азота и одним атомом водорода. Формальные заряды можно определить на основе различий в электроотрицательности.
Вопрос: Как азотистоводородная кислота влияет на цитохром с-оксидазу?
Ответ: Азид водорода ингибирует цитохром с-оксидазу, фермент, участвующий в клеточном дыхании, связываясь с его активным центром и нарушая его функцию.
Вопрос: Какова Ka азотистоводородной кислоты, если 0,20 М азотистоводородной кислоты имеет pH 3,21?
A: Ка азотистоводородной кислоты можно рассчитать, используя pH и уравнение Ka = [H3O+][A-]/[HA]. Для определения значения Ка необходима дополнительная информация.
Вопрос: Какова степень окисления азота в азотистоводородной кислоте (HN3)?
Ответ: Степень окисления азота в азотистоводородной кислоте равна -1.
Вопрос: Каков pH 0,15-молярного раствора HN3, если Ka = 1,8 × 10^-9?
A: pH 0,15-молярного раствора HN3 можно рассчитать, используя значение Ka и уравнение pH = -log10(sqrt(Ka × [HA])).
Вопрос: Как сбалансировать N2 + H2 в HN3?
Ответ: Сбалансированное уравнение реакции N2 + H2 → HN3 будет иметь вид 3N2 + 6H2 → 2HN3.
Вопрос: Как рассчитать Ка HN3?
Ответ: Ка HN3 можно рассчитать, используя равновесную концентрацию продуктов и реагентов реакции диссоциации HN3.
Вопрос: Какова молярность NaN3, если молярность HN3 равна 0,012 М?
Ответ: Молярность NaN3 не может быть определена без дополнительной информации или сбалансированного уравнения реакции между NaN3 и HN3.
Вопрос: Какова правильная структура Льюиса для азотистоводородной кислоты (HN3), включая формальные заряды, если таковые имеются?
Ответ: Правильная структура Льюиса для HN3 включает центральный атом азота, связанный с тремя другими атомами азота и одним атомом водорода. Формальные заряды можно определить на основе различий в электроотрицательности.
