Этилат натрия – сильное основание, образующееся в результате реакции натрия с этанолом. Он используется в органическом синтезе для облегчения таких реакций, как этерификация и депротонирование.
| Название ИЮПАК | Этилат натрия |
| Молекулярная формула | C2H5NaO |
| Количество CAS | 141-52-6 |
| Синонимы | Этанол, натриевая соль; этоксид натрия; Этил натрий; этилат; Этиловый алкоголят натрия |
| ИнЧИ | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Свойства этоксида натрия
Формула этоксида натрия
Химическая формула этилата натрия: C2H5NaO. Он состоит из двух атомов углерода (С), пяти атомов водорода (Н), одного атома натрия (Na) и одного атома кислорода (О). Формула представляет соотношение атомов, присутствующих в молекуле этоксида натрия.
Этоксид натрия Молярная масса
Молярную массу этоксида натрия рассчитывают путем сложения атомных масс всех атомов в его формуле. Натрий (Na) имеет молярную массу 22,99 г/моль, углерод (C) имеет молярную массу 12,01 г/моль, водород (H) имеет молярную массу 1,01 г/моль-моль и кислород (O) имеет молярную массу масса 1,01 г/моль. масса 16,00 г/моль. Их добавление дает молярную массу этилата натрия примерно 68,06 г/моль.
Температура кипения этоксида натрия
Этаксид натрия имеет температуру кипения примерно 90–95°C (194–203°F). Эта температура указывает точку, в которой этоксид натрия переходит из жидкой фазы в газовую фазу при нагревании при стандартном атмосферном давлении.
Температура плавления этоксида натрия
Температура плавления этоксида натрия составляет примерно 260–270°C (500–518°F). Это означает температуру, при которой твердый этоксид натрия переходит в жидкое состояние.
Плотность этоксида натрия г/мл
Этилат натрия имеет плотность примерно 0,868 г/мл. Плотность относится к массе вещества на единицу объема и может использоваться для определения его относительной тяжести или легкости по сравнению с равным объемом воды.
Этоксид натрия Молекулярный вес
Молекулярная масса этоксида натрия, также называемая молекулярной массой, составляет примерно 68,06 г/моль. Его рассчитывают путем сложения атомных масс всех атомов, присутствующих в молекуле этоксида натрия.
Структура этоксида натрия
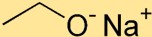
Этилат натрия имеет структуру, в которой атом натрия (Na) связан с атомом кислорода (O) ионной связью. К атому натрия присоединена этоксидная группа, состоящая из двух атомов углерода (С) и пяти атомов водорода (Н).
Растворимость этоксида натрия
Этилат натрия хорошо растворим в полярных растворителях, таких как этанол (C2H5OH) и других органических растворителях. Он легко растворяется в этих растворителях с образованием прозрачного бесцветного раствора, что облегчает его использование в качестве реагента в различных органических реакциях.
| Появление | Бесцветное твердое вещество |
| Удельный вес | 0,868 г/мл |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 68,06 г/моль |
| Плотность | 0,868 г/мл |
| Точка плавления | 260–270°С (500–518°Ф) |
| Точка кипения | 90–95°С (194–203°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует с водой |
| Растворимость | Растворим в этаноле (C2H5OH) и других органических растворителях. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Основной (щелочной) |
Безопасность и опасность этоксида натрия
Этилат натрия представляет несколько рисков для безопасности, поэтому при обращении с ним следует соблюдать осторожность. Это едкое вещество, которое может вызвать серьезные ожоги кожи, глаз и дыхательной системы. Следует избегать прямого контакта и носить перчатки, очки и защитную одежду. Он бурно реагирует с водой, выделяя горючий газообразный водород, поэтому его следует хранить вдали от влаги. Этилат натрия также может бурно реагировать с воздухом, что может привести к возгоранию или взрыву. Хорошая вентиляция имеет решающее значение для предотвращения накопления паров. Кроме того, важно обращаться с этилатом натрия в хорошо оборудованной лаборатории с обученным персоналом, чтобы минимизировать риски и обеспечить безопасность.
| Символы опасности | Коррозионный |
| Описание безопасности | – Вызывает серьезные ожоги<br>- Бурно реагирует при контакте с водой<br>- Хранить в защищенном от влаги месте<br>- Обращаться с осторожностью<br>- Использовать защитное оборудование<br>- Хранить в сухом месте<br>- Обеспечить безопасность хорошая вентиляция |
| Идентификационные номера ООН | ООН2922 |
| код ТН ВЭД | 2905.19.00 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании или вдыхании |
Методы синтеза этоксида натрия
Существует несколько методов синтеза этоксида натрия.
Один из способов синтеза этилата натрия включает реакцию металлического натрия и этанола . Металлический натрий подвергается окислительно-восстановительной реакции с безводным этанолом , в результате чего образуется этоксид натрия. Для проведения реакции можно добавить небольшие кусочки металлического натрия к абсолютному этанолу и кипятить смесь с обратным холодильником в контролируемых условиях.
Другой метод включает реакцию между гидроксидом натрия (NaOH) и этанолом . Гидроксид натрия растворяют в этаноле и смесь нагревают, что ускоряет реакцию с образованием этоксида натрия. Химики обычно используют этот метод, когда не предпочитают прямую реакцию между металлическим натрием и этанолом.
В качестве альтернативы они могут получить этоксид натрия путем реакции этанола с карбонатом натрия (Na2CO3). Растворите карбонат натрия в этаноле , затем нагрейте и перемешайте смесь. Этот процесс приводит к образованию этоксида натрия.
Следует отметить, что данные методы синтеза требуют строгого соблюдения техники безопасности из-за реакционной способности используемых химических веществ. Правильное обращение с легковоспламеняющимися веществами, использование защитных средств и проведение реакций в хорошо вентилируемых помещениях имеют важное значение для личной безопасности и успешного синтеза этоксида натрия.
Использование этоксида натрия
Этилат натрия находит различные применения благодаря своей реакционной способности и сильному основному характеру. Вот некоторые распространенные варианты использования:
- Органический синтез: Этилат натрия широко используется в качестве твердого основания в органическом синтезе. Он облегчает такие реакции, как процессы этерификации, конденсации и депротонирования.
- Алкоксидный реагент: служит алкоксидным реагентом, который может реагировать с различными органическими соединениями с образованием алкоксидов. Эти алкоксиды являются важными промежуточными продуктами во многих органических реакциях.
- Катализатор: Этилат натрия действует как катализатор в нескольких химических реакциях. Он способствует превращению органических соединений, таких как спирты и сложные эфиры, в соответствующие им простые эфиры или продукты этерификации.
- Дегидратирующий агент: обезвоживает органические соединения, удаляя молекулы воды, тем самым облегчая синтез безводных продуктов.
- Полимеризация: Этилат натрия участвует в реакциях полимеризации, включая производство полиэтилентерефталата (ПЭТ) и других полиэфирных полимеров.
- Фармацевтическое производство: находит применение в фармацевтической промышленности для синтеза различных фармацевтических соединений, включая сложные эфиры, простые эфиры и промежуточные соединения.
- Производство биодизельного топлива: в процессе переэтерификации используется этилат натрия для преобразования растительных масел или животных жиров в биодизельное топливо, возобновляемое и экологически чистое топливо.
- Лабораторный реагент: исследователи обычно используют этоксид натрия в качестве реагента для органических реакций и в экспериментальных установках.
Вопросы:
Вопрос: На основе этилата натрия?
Ответ: Да, этоксид натрия является основанием.
Вопрос: Этоксид натрия – сильное или слабое основание?
Ответ: Этилат натрия является сильным основанием.
Вопрос: Чего бы вы ожидали, если бы в воду добавили этилат натрия?
Ответ: Если к воде добавить этоксид натрия, он будет бурно реагировать, выделяя газообразный водород и образуя гидроксид натрия.
Вопрос: Этоксид натрия – сильное или слабое основание?
Ответ: Этилат натрия является сильным основанием.
Вопрос: Является ли этоксид натрия сильным нуклеофилом?
Ответ: Да, этоксид натрия является сильным нуклеофилом.
Вопрос: Что из следующего легче всего вступает в реакцию E2 с этилатом натрия?
Ответ: Соединение с первичной или вторичной уходящей группой легче вступит в реакцию Е2 с этоксидом натрия.
Вопрос: Является ли этоксид натрия сильным нуклеофилом?
Ответ: Да, этоксид натрия является сильным нуклеофилом.
Вопрос: На основе этилата натрия?
Ответ: Да, этоксид натрия является основанием.
Вопрос: Что из следующего легче всего вступает в реакцию E2 с этилатом натрия (NaOCH2CH3)?
Ответ: Соединение с первичной или вторичной уходящей группой легче вступит в реакцию Е2 с этоксидом натрия.
Вопрос: Является ли этоксид натрия легковоспламеняющимся?
Ответ: Этилат натрия сам по себе не является огнеопасным, но бурно реагирует с водой, выделяя легковоспламеняющийся газообразный водород.
Вопрос: Что в сочетании с этанолом образует этоксид натрия и водород?
Ответ: Комбинация металлического натрия и этанола приводит к образованию этилата натрия и газообразного водорода.
Вопрос: Чего бы вы ожидали, если бы в воду добавили этоксид натрия?
Ответ: Если бы этилат натрия добавить в воду, он бы вступил в бурную реакцию с выделением газообразного водорода и образованием гидроксида натрия.
