Хлор (Cl2) — очень активный газ зеленовато-желтого цвета. Его используют при очистке воды, в качестве дезинфицирующего средства и при производстве различных химикатов, таких как ПВХ и растворителей.
| Название ИЮПАК | Дихлор |
| Молекулярная формула | кл2 |
| Количество CAS | 7782-50-5 |
| Синонимы | Молекулярный хлор, Хлор, Хлоро, Хлор, Хлор, Хлорето де хлоро |
| ИнЧИ | ИнХИ=1S/Cl2/c1-2 |
Cl2 Молярная масса
Молярная масса Cl2, или хлора, представляет собой сумму атомных масс двух атомов хлора или 70,906 г/моль. Знать молярную массу Cl2 важно при расчете количества вещества, необходимого для химической реакции, или при переводе между различными единицами измерения.
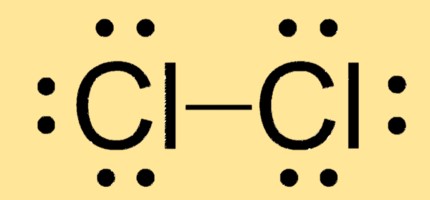
Структура Льюиса Cl2
Cl2 имеет линейную молекулярную геометрию с двумя атомами хлора, связанными одной ковалентной связью. Его структура Льюиса состоит из двух атомов Cl с тремя неподеленными парами и одной общей электронной парой.
Точка кипения Cl2
Температура кипения Cl2 составляет -34,04°C (-29,27°F) при стандартном давлении. Это относительно низкая температура кипения, при которой образуется газообразный Cl2 при комнатной температуре и давлении. Важно соблюдать осторожность при обращении с Cl2, так как он легко может превратиться в жидкость или твердое вещество при низких температурах и давлении.
Cl2 Точка плавления
Температура плавления Cl2 составляет -101,5°C (-150,7°F) при стандартном давлении. Это относительно низкая температура плавления, при которой образуется газообразный Cl2 при комнатной температуре и давлении. Важно соблюдать осторожность при обращении с Cl2, так как он легко может превратиться в жидкость или твердое вещество при низких температурах и давлении.
Cl2 Плотность г/мл
Плотность Cl2 составляет 0,003214 г/мл при стандартных температуре и давлении (СТП). Это означает, что Cl2 гораздо менее плотен, чем воздух, и будет подниматься в атмосферу. Cl2 можно хранить в баллонах под давлением или в резервуарах, содержащих газы тяжелее воздуха, например азот.
Молекулярный вес хлора
Молекулярная масса Cl2 составляет 70,906 г/моль. Это масса одного моля Cl2, содержащего число молекул Авогадро (6,022 х 10^23). Молекулярная масса Cl2 важна для стехиометрических расчетов в химии.
Структура хлора
Структура Cl2 линейная: два атома хлора связаны между собой ковалентной связью. Длина связи между двумя атомами хлора составляет 1,99 ангстрем, а энергия связи — 242 кДж/моль. Электронная конфигурация Cl2 — [Ne]3s23p5, где каждый атом хлора вносит один электрон в связующую пару.
Формула хлора
Формула Cl2 — это просто два атома Cl, связанных вместе. Это представлено Cl-Cl или Cl2. Формула важна для определения состава соединения или молекулы, а также для стехиометрических расчетов в химии.
| Появление | Зеленовато-желтый газ |
| Удельный вес | 1,56 (жидкость) |
| Цвет | зеленовато-желтый |
| Запах | Резкий и удушливый запах |
| Молярная масса | 70,906 г/моль |
| Плотность | 0,003214 г/мл при СТП |
| Точка плавления | -101,5°C (-150,7°F) |
| Точка кипения | -34,04°C (-29,27°F) |
| Мигающая точка | Не воспламеняется |
| Растворимость в воде | 0,92 г/100 мл при 20°С |
| Растворимость | Растворим в воде, этаноле, эфире, бензоле и многих органических растворителях. |
| Давление газа | 102,44 кПа при 20°C |
| Плотность пара | 2,49 (воздух = 1) |
| пКа | – |
| рН | – |
Cl2 Безопасность и опасности
Хлор — это высокореактивный газ, который при неправильном обращении может представлять серьезную угрозу для безопасности и здоровья. Он может вызвать серьезное раздражение дыхательных путей и повреждение глаз, кожи и слизистых оболочек. Вдыхание высоких концентраций хлора может вызвать отек легких, который может быть опасен для жизни. Хлор также очень агрессивен и может повредить металлы, пластмассы и другие материалы. Для обеспечения безопасного обращения с хлором следует использовать соответствующие средства индивидуальной защиты, такие как очки, перчатки и респиратор. Хлор следует использовать только в хорошо проветриваемых помещениях, а все контейнеры должны быть надлежащим образом маркированы и храниться в безопасном месте.
| Символы опасности | Череп и кости |
| Описание безопасности | Высокотоксичный и агрессивный газ; вызывает сильное раздражение дыхательных путей и кожи; может быть смертельным при вдыхании в высоких концентрациях |
| Идентификационные номера ООН | ООН1017 |
| код ТН ВЭД | 2801,1 |
| Класс опасности | 2.3 |
| Группа упаковки | я |
| Токсичность | Очень токсичен; вдыхание высоких концентраций может вызвать отек легких и привести к летальному исходу. |
Методы синтеза хлора
Существуют различные методы синтеза газообразного хлора, включая электролиз рассола, окисление HCl и термическое разложение хлоридов металлов.
Наиболее распространенным методом является электролиз рассола, при котором электрический ток пропускают через раствор хлорида натрия (NaCl) и воды (H2O). Этот процесс генерирует газообразный хлор на аноде и газообразный водород на катоде.
Другой метод получения хлора — окисление HCl окислителем, например KMnO4 или MnO2. В результате этой реакции в качестве побочных продуктов образуются газообразный хлор и вода.
Термическое разложение хлоридов металлов, таких как MgCl2 или FeCl3, является еще одним методом получения газообразного хлора. Этот процесс включает нагревание хлорида металла до высокой температуры, что приводит к его разложению и выделению газообразного хлора.
В целом, метод синтеза хлора зависит от конкретного применения и желаемой чистоты газа. Независимо от используемого метода, важно обращаться с хлором с осторожностью из-за его высокой реакционной способности и токсичности.
Использование хлора
Газообразный хлор имеет широкий спектр применения в различных отраслях промышленности. Одним из основных применений хлора является производство поливинилхлорида (ПВХ), широко используемого пластика. Хлор также используется в производстве других соединений хлора, таких как хлороформ и четыреххлористый углерод, которые используются в качестве растворителей и при производстве хладагентов.
В промышленности по очистке воды хлор обычно используется в качестве дезинфицирующего средства для очистки питьевой воды и сточных вод. Газообразный хлор эффективен для уничтожения бактерий и вирусов, а также может окислять и удалять из воды органические соединения и другие загрязнения.
В целлюлозно-бумажной промышленности газообразный хлор используется в качестве отбеливателя для отбеливания бумажных изделий. Он также используется в производстве текстиля, например, нейлона и полиэстера, а также при производстве красителей и пигментов.
Газообразный хлор имеет и другие применения, в частности, в производстве некоторых фармацевтических продуктов и в металлургической промышленности для зачистки и очистки металлических поверхностей. Однако из-за его опасного характера с хлором следует обращаться осторожно и принимать соответствующие меры безопасности при его хранении, транспортировке и использовании.
Вопросы:
Вопрос: Cl2 полярный или неполярный?
Ответ: Cl2 — неполярная молекула.
Вопрос: Является ли хлор металлом?
Ответ: Нет, хлор не металл. Это галоген и принадлежит к группе неметаллических элементов.
Вопрос: Какой мягкий металл в сочетании с хлором образует поваренную соль?
Ответ: Натрий (Na) — это мягкий металл, который в сочетании с хлором (Cl) образует поваренную соль (NaCl).
Вопрос: Как хлорировать воду?
Ответ: Хлорирование воды обычно осуществляется путем добавления в водопроводную воду определенного количества газообразного хлора, гипохлорита натрия или гипохлорита кальция. Количество добавляемого хлора зависит от качества воды и желаемого уровня дезинфекции. Хлор вступает в реакцию с бактериями и другими микроорганизмами в воде, эффективно убивая их и делая воду безопасной для питья.
Вопрос: Что из перечисленного обрабатывают хлором для получения отбеливающего порошка?
Ответ: Оксид кальция (CaO) обрабатывают хлором (Cl2) для получения отбеливающего порошка (CaOCl2).
