Хлорид кальция — хорошо растворимое неорганическое соединение формулы CaCl2. Он обычно используется в качестве противогололедного агента, осушителя, а также при производстве солей кальция и химикатов.
| Название ИЮПАК | Хлорид кальция |
| Молекулярная формула | CaCl2 |
| Количество CAS | 10043-52-4 |
| Синонимы | Дихлорид кальция, хлорид кальция (II) |
| Е509, соль маринованная, Дауфлейк, Пеладов, ТЕТРА | |
| ИнЧИ | InChI=1S/Ca.2ClH/ч;2*1H/q+2;;/p-2 |
Формула хлорида кальция
Химическая формула хлорида кальция: CaCl2. Это означает, что каждая единица хлорида кальция состоит из одного иона кальция (Ca2+) и двух ионов хлорида (Cl-). Хлорид кальция является ионным соединением, то есть он удерживается вместе за счет электростатического притяжения между положительно заряженным ионом кальция и отрицательно заряженными ионами хлорида.
Молярная масса of хлорид кальция
Хлорид кальция имеет молярную массу 110,98 г/моль, что соответствует сумме атомных масс одного атома Ca и двух атомов Cl. Это неорганическое соединение, хорошо растворяющееся в воде. воды и обычно используется в качестве осушителя, осушителя и антиобледенителя. Хлорид кальция также используется в производстве солей кальция и других химических веществ.
Температура кипения CaCl2
Температура кипения CaCl2 составляет 1935°С, что очень высоко для неорганического соединения. Это связано с прочными ионными связями между ионами Ca+2 и Cl-, для разрыва которых требуется много энергии. CaCl2 — гигроскопичное соединение, то есть оно поглощает влагу из воздуха и может растворяться в воде с образованием высококонцентрированного раствора.
Температура плавления CaCl2
CaCl2 имеет температуру плавления 772°C. Он имеет кристаллическую структуру и обычно встречается в безводной форме, то есть не содержит молекул воды. При нагревании CaCl2 разлагается на оксид кальция и газообразный хлористый водород.
Плотность CaCl2 г/мл
Плотность CaCl2 зависит от концентрации раствора. 1 М раствор CaCl2 имеет плотность около 1,4 г/мл, а 3 М раствор — около 1,6 г/мл. Плотность твердого CaCl2 составляет 2,15 г/см³.
Молекулярный вес CaCl2
Молекулярная масса CaCl2 составляет 110,98 г/моль. Это неорганическое соединение, состоящее из одного атома Ca и двух атомов Cl. CaCl2 представляет собой белое кристаллическое твердое вещество при комнатной температуре, хорошо растворимое в воде.
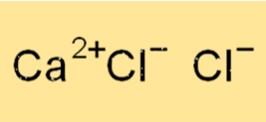
Структура CaCl2
CaCl2 имеет структуру кристаллической решетки, которая удерживается ионными связями между катионом кальция (Ca2+) и хлорид-анионом (Cl-). Каждый ион Ca+2 окружен шестью ионами Cl-, а каждый ион хлорида окружен шестью ионами кальция. Кристаллическая структура CaCl2 кубическая, каждая элементарная ячейка содержит один ион кальция и два иона хлорида.
| Появление | Белый твердый |
| Удельный вес | 2,15 (твердое), 1,4-1,6 (раствор) |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 110,98 г/моль |
| Плотность | 2,15 г/см³ (твердое), 1,4-1,6 г/см³ (раствор) |
| Точка плавления | 772°С |
| Точка кипения | 1935°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим в воде |
| Растворимость | Растворим в этаноле и ацетоне |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | – |
| рН | 4,5-11,0 (10% раствор) |
Безопасность и опасность хлорида кальция
CaCl2 может вызвать раздражение кожи и глаз, а вдыхание его пыли или тумана может вызвать раздражение дыхательных путей. Он также может вызвать ожоги при попадании на кожу или в глаза. CaCl2 гигроскопичен, то есть он может поглощать влагу и выделять тепло, что может привести к разрыву или взрыву контейнеров. Он также вызывает коррозию некоторых металлов и может вступать в реакцию с некоторыми органическими материалами. При работе с CaCl2 следует использовать соответствующее защитное оборудование, такое как перчатки и очки. Разливы следует немедленно убирать, а контейнеры хранить в прохладном, сухом, хорошо проветриваемом помещении.
| Символы опасности | Коррозионное, Раздражающее |
| Описание безопасности | Надевайте защитные перчатки и средства защиты глаз/лица. Не вдыхать пыль/дым/газ/туман/пары. |
| Идентификационные номера ООН | ООН 3077, ООН 1786 (гидратированные унции) |
| код ТН ВЭД | 2827.39.90 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | III |
| Токсичность | Токсичность низкая для большинства применений, но может быть опасна в больших количествах. |
Методы синтеза хлорида кальция
Для синтеза CaCl2 доступно несколько методов.
Один метод включает взаимодействие карбоната или гидроксида кальция с соляной кислотой . Один из методов — добавить карбонат или гидроксид кальция к соляной кислоте . Раствор испаряется с образованием CaCl2.
Другой метод — взаимодействие оксида кальция с соляной кислотой . Этот метод включает добавление оксида кальция к соляной кислоте и последующее выпаривание раствора с получением CaCl2.
Третий метод включает реакцию металлического кальция с газообразным хлором . Менее распространенный метод — нагревание металлического кальция в присутствии газообразного хлора. В результате реакции образуется CaCl2, но эксперты не часто используют этот подход из-за высокой реакционной способности металлического кальция и необходимости специального обращения.
Чтобы получить CaCl2 другим методом, можно использовать побочный продукт процесса Сольвея, в результате которого образуется хлорид натрия и CaCl2. Этот процесс включает извлечение CaCl2 из побочного продукта посредством методов фильтрации, выпаривания и очистки. Эти шаги помогают удалить все примеси и получить CaCl2 высокой чистоты.
Использование хлорида кальция
CaCl2 имеет множество промышленных применений:
- Используется в качестве осушителя для поглощения влаги, антиобледенителя для дорог и тротуаров, а также коагулянта при производстве тофу и других продуктов питания.
- Используется в нефтегазовой отрасли для повышения плотности буровых растворов и снижения температуры замерзания воды в трубопроводах.
- Используется в бетонных смесях для ускорения процесса твердения и повышения прочности и долговечности готового изделия.
- Используется в производстве бумаги для повышения прочности и стабильности бумажных волокон.
- Используется в водоподготовке для удаления примесей и смягчения воды.
- Используется в качестве источника ионов кальция в медицинских целях, например, для внутривенного введения жидкостей и для лечения гипокальциемии.
- Используется в производстве пластмасс и резины для повышения твердости и долговечности конечного продукта.
- Используется при консервировании фруктов и овощей для предотвращения порчи и сохранения текстуры и вкуса продукта.
- Используется в текстильном производстве для улучшения впитывания красителей, увеличения прочности и гибкости волокон.
- Также используется в производстве огнетушителей и в качестве компонента огнезащитных материалов для предотвращения распространения огня.
Вопросы:
Вопрос: Что такое хлорид кальция?
Ответ: Хлорид кальция представляет собой химическое соединение, состоящее из ионов Ca2+ и Cl-, имеющее химическую формулу CaCl2.
Вопрос: Является ли хлорид кальция ионным или ковалентным?
Ответ: CaCl2 является ионным соединением, поскольку он состоит из положительно заряженных ионов Ca2+ и отрицательно заряженных ионов Cl-, удерживаемых вместе ионными связями.
Вопрос: Для чего используется хлорид кальция?
Ответ: CaCl2 имеет множество промышленных, коммерческих и медицинских применений, в том числе в качестве осушителя, антиобледенителя, коагулянта в производстве продуктов питания, ускорителя бетона, умягчителя воды и источника ионов кальция в медицинских целях.
Вопрос: Какова формула хлорида кальция?
Ответ: Формула хлорида кальция — CaCl2, что означает, что каждая молекула содержит один ион кальция и два иона хлорида.
Вопрос: Является ли CaCl2 ионным или ковалентным?
Ответ: CaCl2 является ионным соединением, поскольку он состоит из положительно заряженных ионов кальция и отрицательно заряженных ионов хлорида, удерживаемых вместе ионными связями.
Вопрос: Растворим ли CaCl2 в воде?
Ответ: Да, CaCl2 хорошо растворим в воде, то есть он легко растворяется в воде с образованием прозрачного раствора.
Вопрос: Если CaCl2 растворить в воде, что можно сказать о концентрации иона Ca2+?
Ответ: Когда CaCl2 растворяется в воде, он диссоциирует на составляющие его ионы: Ca2+ и 2Cl-. Поскольку CaCl2 полностью диссоциирует в воде, концентрация ионов Ca2+ в растворе в два раза превышает концентрацию CaCl2.
