Хлорат калия (KClO3) – химическое соединение, состоящее из калия, хлора и кислорода. Благодаря своим окислительным свойствам его широко используют в производстве спичек, взрывчатых веществ и фейерверков.
| Название ИЮПАК | Хлорид калия |
| Молекулярная формула | KClO3 |
| Количество CAS | 3811-04-9 |
| Синонимы | Хлорат калия, хлоркалий, хлорат калия, перхлорат калия, ООН 1485, хлорат калия, Kalium perchromicum |
| ИнЧИ | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
Свойства хлората калия
Формула хлората калия
Хлорат калия имеет химическую формулу KClO3, которая указывает на то, что он состоит из одного атома калия, одного атома хлора и трех атомов кислорода. Это ионное соединение, которое образуется при объединении ионов K+ и ClO3- через ионную связь. Соединение очень реакционноспособно из-за присутствия кислорода, что придает ему сильные окислительные свойства.
хлорат калия Молярная масса
Молярная масса KClO3 составляет 122,55 г/моль. Это сумма атомных масс отдельных элементов, входящих в состав соединения, а именно калия, хлора и кислорода. Молярная масса является важным параметром в химии, поскольку она используется для расчета массы вещества, необходимой для производства определенного количества продукта в химической реакции.
Температура кипения хлората калия
KClO3 не имеет четко определенной температуры кипения, поскольку он разлагается, не достигнув точки кипения. При нагревании разлагается на хлорид калия и газообразный кислород. Следовательно, KClO3 подвергается реакции термического разложения, а не кипения.
Хлорат калия Температура плавления
Температура плавления KClO3 составляет 356°C (673°F). При этой температуре твердое соединение плавится и превращается в жидкость. Температура плавления является важным свойством соединения, поскольку она влияет на физическое поведение вещества, включая его растворимость и плотность.
Плотность хлората калия г/мл
Плотность KClO3 составляет 2,32 г/мл при комнатной температуре. Это означает, что определенный объем соединения имеет определенную массу, которая полезна при определении массы вещества, необходимой для конкретной химической реакции. Плотность KClO3 также влияет на его растворимость в воде, поскольку соединения с более высокой плотностью, как правило, менее растворимы в воде.
Хлорат калия Молекулярный вес
Молекулярная масса KClO3 составляет 122,55 г/моль. Это сумма атомных весов составляющих его атомов, а именно калия, хлора и кислорода. Молекулярная масса является важным параметром в стехиометрии, поскольку она используется для расчета количества реагентов и продуктов химической реакции.
Структура хлората калия
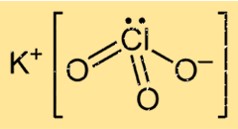
KClO3 в твердой форме имеет кристаллическую структуру, состоящую из атомов калия, хлора и кислорода, расположенных определенным образом. Соединение образует гранецентрированную кубическую кристаллическую решетку, в которой каждый ион калия окружен шестью атомами кислорода, а каждый ион кислорода окружен четырьмя атомами калия и двумя атомами хлора.
Растворимость хлората калия
KClO3 умеренно растворим в воде, растворимость 7 г/100 мл воды при комнатной температуре. Растворимость соединения увеличивается с температурой, поскольку молекулы воды обладают большей кинетической энергией и могут растворить большее количество соединения. KClO3 также растворим в других полярных растворителях, таких как этанол и ацетон.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,32 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 122,55 г/моль |
| Плотность | 2,32 г/см³ |
| Точка плавления | 356°С (673°Ф) |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | 7 г/100 мл при 20°С |
| Растворимость | Растворим в этаноле и ацетоне |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 1,8 (Ка = 1,6 × 10⁻⁵) |
| рН | pH 0,1 М раствора составляет примерно от 6,5 до 7,5. |
Безопасность и опасность хлората калия
KClO3 — высокореактивное и потенциально опасное вещество, поэтому обращаться с ним следует с особой осторожностью. Он может вызвать серьезное раздражение кожи и глаз и может быть токсичным при проглатывании или вдыхании. При нагревании он может бурно реагировать и даже взорваться. KClO3 также может сильно реагировать с другими химическими веществами, такими как серная кислота и органические соединения, и выделять токсичные газы, такие как хлор и диоксид хлората. При работе с KClO3 важно соблюдать надлежащие правила техники безопасности, в том числе носить защитное оборудование и работать в хорошо проветриваемом помещении.
| Символы опасности | О, Си, Н |
| Описание безопасности | Избегайте контакта с горючими материалами. Токсично при проглатывании. Вызывает серьезные ожоги кожи и повреждения глаз. |
| Идентификационные номера ООН | ООН1485 |
| код ТН ВЭД | 2829.90.10 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза хлората калия
Существует несколько методов синтеза KClO3.
Один метод включает реакцию между хлоридом калия и отбеливателем. Этот метод включает добавление раствора отбеливателя к раствору хлорида калия и перемешивание смеси. Чтобы получить KClO3, отфильтруйте и промойте полученный осадок.
Другой метод включает электролиз раствора, содержащего хлорид калия , воду и источник кислорода. Электролитическая ячейка, специализированное устройство, выполняет этот процесс, разделяя ионы калия и хлорида и производя газообразный кислород. Кислород реагирует с ионами калия с образованием KClO3.
Третий метод включает реакцию между гидроксидом калия и газообразным хлором, в результате которой образуется KClO3 с хлоридом калия и водой. Этот метод требует тщательного контроля температуры и концентрации реагентов для обеспечения оптимального выхода.
Использование хлората калия
KClO3 имеет широкий спектр применения в различных отраслях промышленности, в том числе:
- Пиротехнические изделия: обычно используются в качестве окислителя в фейерверках и других пиротехнических устройствах.
- Спички: используются в безопасных спичечных головках, которые воспламеняются при ударе о шероховатую поверхность.
- Удобрение: используется в качестве источника калия для удобрений для растений.
- Отбеливатель: используется в качестве отбеливателя для текстиля, бумаги и других материалов.
- Лабораторный реагент: также используется в качестве лабораторного реагента для различных химических реакций.
- Медицинское применение: используется в медицинских целях для лечения определенных типов кожных заболеваний, таких как экзема.
- Взрывчатые вещества: общий ингредиент некоторых типов взрывчатых веществ, таких как детонаторы и динамит.
- Окислитель: используется в качестве окислителя при производстве некоторых химических веществ, таких как перхлораты.
Вопросы:
Вопрос: Сколько граммов хлорида калия образуется при разложении 25 г хлората калия?
Ответ: При разложении 25 г KClO3 образуется 13,47 г хлорида калия.
Вопрос: Как сделать хлорат калия?
Ответ: KClO3 можно получить путем взаимодействия хлорида калия с отбеливателем, электролизом раствора, содержащего хлорид калия, или путем взаимодействия гидроксида калия с газообразным хлором.
Вопрос: Сколько молей кислорода образуется при разложении 2 молей хлората калия (kclo3)?
Ответ: При разложении 2 молей KClO3 образуется 3 моля газообразного кислорода.
Вопрос: Раствор объемом 0,70 мл содержит 3,0 г хлората калия (kclo3). Каков объем раствора?
А: Объем 0,70 мл раствора, содержащего 3,0 г KClO3, составляет 51,4 мл.
Вопрос: Является ли хлорат калия летучим?
Ответ: KClO3 не считается летучим веществом, поскольку имеет относительно высокую температуру плавления и кипения.
Вопрос: Сколько kcl образуется, если разложить 2,50 г kclo3?
Ответ: При разложении 2,50 г KClO3 образуется 1,35 г хлорида калия.
Вопрос: Растворим ли kclo3 в воде?
О: Да, KClO3 хорошо растворим в воде, его растворимость составляет 7 г/100 мл при комнатной температуре.
Вопрос: Сколько граммов кислорода можно получить при разложении 100 г kclo3?
Ответ: При разложении 100 г KClO3 образуется 45,02 г газообразного кислорода.
