Фторид меди (CuF2) представляет собой соединение меди и фтора. Он имеет зеленовато-синий цвет и находит применение в различных отраслях промышленности, включая электронику и катализ.
| Название ИЮПАК | Фторид меди(II) |
| Молекулярная формула | CuF2 |
| Количество CAS | 7789-19-7 |
| Синонимы | Фторид меди, Дифторид меди |
| ИнЧИ | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Свойства фторида меди
Формула фторида меди
Формула дифторида меди — CuF2. Он состоит из одного атома меди (Cu) и двух атомов фтора (F). Это ионное соединение образует стабильную кристаллическую структуру благодаря электростатическому притяжению между положительно заряженным ионом меди и отрицательно заряженными ионами фтора.
фторид меди Молярная масса
Молярная масса дифторида меди (CuF2) рассчитывается путем сложения атомных масс составляющих его элементов. Медь имеет молярную массу примерно 63,55 г/моль, а фтор имеет молярную массу примерно 18,99 г/моль. Сложив их, получим молярную массу дифторида меди примерно 101,09 г/моль.
Температура кипения фторида меди
Дифторид меди не имеет четко определенной температуры кипения, поскольку он подвергается разложению до достижения точки кипения. При высоких температурах дифторид меди начинает разлагаться на дифторид меди (CuF) и газообразный фтор (F2). Поэтому он считается термически нестабильным.
Температура плавления фторида меди
Дифторид меди имеет температуру плавления примерно 840°C (1544°F). При этой температуре твердые кристаллы дифторида меди поглощают достаточно энергии для перехода в расплавленное состояние, что позволяет использовать их в различных высокотемпературных приложениях.
Плотность фторида меди г/мл
Плотность дифторида меди составляет примерно 4,23 г/мл. Это значение плотности указывает на то, что дифторид меди является относительно плотным материалом, который может быть полезен в конкретных приложениях, где требуется высокая плотность.
Молекулярный вес фторида меди
Молекулярная масса дифторида меди (CuF2) составляет примерно 101,09 г/моль. Он рассчитывается путем сложения атомных масс меди и двух атомов фтора, присутствующих в формуле.
Структура фторида меди
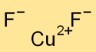
Дифторид меди принимает кристаллическую структуру, образующую сетчатую структуру катионов Cu2+ и анионов F-. Катионы меди окружены шестью ионами фтора, и каждый ион фтора контактирует с тремя ионами меди.
Растворимость фторида меди
Дифторид меди плохо растворяется в воде. Образует плохо растворимые соли, которые выделяют в раствор ионы Cu2+ и F-. Это свойство важно в различных химических процессах и применениях, включая неорганический синтез и электрохимические применения.
| Появление | Зеленовато-голубое твердое вещество |
| Удельный вес | 4,23 г/мл |
| Цвет | зеленовато-синий |
| Запах | Без запаха |
| Молярная масса | 101,09 г/моль |
| Плотность | 4,23 г/см³ |
| Точка плавления | 840°С (1544°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Слабый, образует малорастворимые соли |
| Растворимость | Плохо растворим |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Непригодный |
| рН | Нейтральный |
Безопасность и опасность фторида меди
Дифторид меди вызывает ряд вопросов безопасности и опасности. Прямой контакт с составом может вызвать раздражение кожи и глаз. Вдыхание его пыли или паров может вызвать проблемы с дыханием. При нагревании он может выделять токсичный газообразный фтор, который вреден при вдыхании. Поэтому при работе с дифторидом меди следует использовать соответствующую вентиляцию и средства индивидуальной защиты. Кроме того, важно избегать приема внутрь, поскольку это может привести к расстройству желудочно-кишечного тракта. Соединение следует хранить в герметичных контейнерах, вдали от несовместимых материалов, чтобы избежать реакций. Надлежащие протоколы безопасности и методы обращения необходимы для минимизации рисков, связанных с дифторидом меди.
| Символы опасности | Раздражающий |
| Описание безопасности | Вызывает раздражение кожи и глаз. Вреден при вдыхании. При нагревании может выделять токсичный газообразный фтор. Избегайте приема внутрь. Используйте подходящую вентиляцию и защитное оборудование. |
| Идентификационные номера ООН | Н/Д |
| код ТН ВЭД | 2826.92.00 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | III |
| Токсичность | Токсичный |
Методы синтеза фторида меди
Существуют различные методы синтеза дифторида меди. Распространенный подход заключается в добавлении оксида меди (CuO) или карбоната меди (CuCO3) в контейнер и тщательном перемешивании при добавлении в контейнер плавиковой кислоты (HF) . Реакция продолжается, в качестве побочных продуктов образуются дифторид меди и вода.
Другой метод включает реакцию металлической меди или медного порошка с газообразным фтором (F2) при высоких температурах. Этот процесс требует осторожного обращения из-за реакционной способности газообразного фтора. Он образует дифторид меди непосредственно за счет сочетания атомов меди и фтора.
Кроме того, получение дифторида меди может происходить путем взаимодействия хлорида меди (II) (CuCl2) с фторидом натрия (NaF) в водном растворе. В результате реакции образуется дифторид меди, а также хлорид натрия в качестве побочного продукта.
Эти методы синтеза требуют мер безопасности и соответствующего оборудования из-за реакционной способности некоторых используемых химических веществ. Точный контроль условий реакции имеет решающее значение для получения высоких выходов чистого дифторида меди.
Использование фторида меди
Дифторид меди находит ряд ценных применений благодаря своим уникальным свойствам и характеристикам. Вот некоторые ключевые варианты использования:
- Электроника: Дифторид меди используется в полупроводниковой промышленности в качестве источника ионов меди для процессов осаждения тонких пленок. Она является пионером в производстве электронных устройств и интегральных схем.
- Катализ: он действует как катализатор в различных химических реакциях, включая синтез органических соединений и в промышленных процессах, таких как реакции фторирования.
- Источник фтора: Дифторид меди используется для производства газообразного фтора (F2) путем высокотемпературного разложения, что необходимо для различных промышленных применений.
- Керамика и стекло: соединение используется в качестве добавки при производстве керамики и стекла для изменения свойств материала и улучшения его характеристик.
- Стоматологические материалы. Дифторид меди добавляют в стоматологические продукты, такие как зубные пасты и жидкости для полоскания рта, для усиления их противокариесных и антибактериальных свойств.
- Покрытия: используется в специальных покрытиях, таких как антибликовые покрытия для оптических устройств и защитные покрытия для металлических поверхностей.
- Антипирены: дифторид меди используется в качестве добавки в огнезащитных материалах, помогая снизить воспламеняемость различных продуктов.
- Химический реагент: В лабораториях и исследованиях дифторид меди используется в качестве реагента в конкретных химических реакциях и анализах.
Универсальность дифторида меди делает его ценным во многих отраслях, от электроники до здравоохранения, где его уникальные свойства используются для повышения производительности и безопасности. Однако правильное обращение и меры предосторожности необходимы из-за его реакционной способности и потенциальных опасностей.
Вопросы:
Вопрос: Какова массовая формула фторида меди (II)?
A: Формула массы дифторида меди(II) (CuF2) составляет примерно 101,09 г/моль.
Вопрос: Какая из следующих формул является правильной для фторида меди (II)?
Ответ: Правильная формула дифторида меди(II) — CuF2.
Вопрос: Очищает ли медь фторид?
О: Нет, медь не очищает дифторид. Медь не обладает способностью удалять дифторид из воды.
Вопрос: Что представляет собой ковалентное соединение NaCl, KCl, CuF2 и CF4?
A: Ковалентное соединение — CF4 (тетрафторид углерода).
Вопрос: Что образуется на электродах при электролизе водного раствора CuF2?
А: На аноде образуется газообразный кислород (O2), а на катоде — металлическая медь (Cu).
Вопрос: Как называется CuF2 в стандартной системе?
Ответ: Название CuF2 в стандартной системе — дифторид меди(II).
Вопрос: Каков заряд иона меди в соединении CuF2?
Ответ: Заряд иона меди в CuF2 равен +2.
Вопрос: CuF2 ионный или молекулярный?
Ответ: CuF2 — ионное соединение.
Вопрос: Каков заряд ионного соединения CuF2?
A: Ионное соединение CuF2 нейтрально.
Вопрос: Как называется соединение с формулой CuF2?
A: Название соединения формулы CuF2 — дифторид меди(II).
