Углекислота (H2CO3) образуется при растворении углекислого газа в воде и играет решающую роль в регулировании pH океана и контроле выветривания горных пород.
| Название ИЮПАК | Угольная кислота |
| Молекулярная формула | H2CO3 |
| Количество CAS | 463-79-6 |
| Синонимы | Кислый воздух; Кислый воздух; Н2СО3; оксиданиумилиденметан; Кислота карбонатная; гидроксикетон; Дигидроксиметанон |
| ИнЧИ | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Формула угольной кислоты
Химическая формула угольной кислоты — H2CO3, что указывает на то, что она состоит из двух атомов водорода, одного атома углерода и трех атомов кислорода. Формула также показывает соотношение атомов в молекуле, что важно для определения стехиометрии химических реакций с участием угольной кислоты.
Молярная масса of угольная кислота
Молярная масса угольной кислоты составляет примерно 62,03 г/моль. Это слабая кислота, которая образуется при растворении углекислого газа в воде и отвечает за регулирование pH океанов. Молярная масса угольной кислоты важна для расчета количества кислоты, необходимой для достижения определенного pH в растворе, и для определения того, сколько углекислого газа можно растворить в воде.
Температура кипения угольной кислоты
Углекислота не имеет четко определенной температуры кипения, поскольку до достижения точки кипения она распадается на воду и углекислый газ. Однако при атмосферном давлении угольная кислота разлагается при температуре примерно 333 К (60 °С) на воду и углекислый газ.
Температура плавления угольной кислоты
Углекислота также не имеет четко определенной температуры плавления, так как она распадается на воду и углекислый газ, прежде чем достигнет точки плавления. Однако при атмосферном давлении угольная кислота при температуре примерно 273 К (-0,15 °С) разлагается на воду и углекислый газ.
Плотность угольной кислоты г/мл
Плотность угольной кислоты составляет примерно 1,67 г/мл при комнатной температуре (25°C). Эта величина может меняться в зависимости от концентрации раствора, а также температуры и давления окружающей среды.
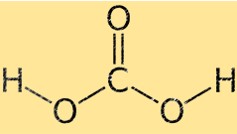
Структура угольной кислоты
Углекислота имеет тетраэдрическую молекулярную геометрию: атом углерода находится в центре, а четыре окружающих атома (два кислорода и два водорода) расположены в углах тетраэдра. Два атома кислорода связаны с атомом углерода двойными связями, а два атома водорода — одинарными связями.
Молекулярный вес угольной кислоты
Молекулярная масса угольной кислоты составляет 62,03 г/моль. Это значение рассчитывается путем сложения атомных масс составляющих элементов: водорода (H), углерода (C) и кислорода (O).
| Появление | Бесцветная жидкость или кристаллическое твердое вещество |
| Удельный вес | 1,67 г/см³ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 62,03 г/моль |
| Плотность | 1,67 г/мл при комнатной температуре (25°C) |
| Точка плавления | Разлагается при температуре примерно 273 К (-0,15 ° C). |
| Точка кипения | Разлагается примерно при 333 К (60°С). |
| Мигающая точка | Непригодный |
| Растворимость в воде | Полностью растворим |
| Растворимость | Растворим в воде, этаноле, метаноле. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 3,6 (первая диссоциация) |
| рН | 5,6 (в 0,1М растворе) |
Угольная кислота Безопасность и опасности
Углекислота (H2CO3) обычно считается безопасной, но в определенных ситуациях она может представлять некоторую опасность. Воздействие H2CO3 может вызвать раздражение глаз, кожи и дыхательной системы, а также привести к кашлю, хрипу и одышке. Проглатывание H2CO3 может вызвать расстройство желудка, тошноту и рвоту. H2CO3 также является слабой кислотой и может реагировать с некоторыми металлами, такими как алюминий и цинк, с образованием легковоспламеняющегося газообразного водорода. При обращении или использовании H2CO3 следует принять соответствующие меры предосторожности, включая ношение защитной одежды и достаточную вентиляцию. В случае воздействия следует немедленно обратиться за медицинской помощью.
| Символы опасности | Никто |
| Описание безопасности | Нетоксичный |
| Идентификационные номера ООН | 1824 год |
| код ТН ВЭД | 28111990 |
| Класс опасности | 8 – Коррозионные вещества |
| Группа упаковки | III |
| Токсичность | Низкая токсичность |
Методы синтеза угольной кислоты
H2CO3 можно синтезировать разными методами. Распространенным методом является реакция диоксида углерода (CO2) с водой (H2O) в присутствии катализатора. Этот процесс, называемый гидратацией, приводит к образованию углекислоты:
CO2 + H2O → H2CO3
Другой метод синтеза угольной кислоты включает взаимодействие карбоната кальция (CaCO3) с кислотой, например соляной кислотой (HCl). Этот процесс, называемый подкислением, приводит к образованию углекислоты:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Реакция между щавелевой кислотой и карбонатом, например карбонатом натрия (Na2CO3), позволяет синтезировать угольную кислоту. В результате этого процесса образуется угольная кислота и соль, например оксалат натрия:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
В процессе Сольвея угольная кислота и бикарбонат натрия образуются в результате реакции карбоната натрия (Na2CO3) с диоксидом углерода в присутствии воды.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
В целом существует несколько методов синтеза угольной кислоты, каждый из которых имеет свои преимущества и ограничения. Выбор метода будет зависеть от таких факторов, как желаемая чистота продукта, наличие сырья и необходимый масштаб производства.
Использование угольной кислоты
Углекислота (H2CO3) — универсальное соединение, которое находит множество применений в промышленности, медицине и быту. Некоторые из основных применений H2CO3 включают:
- Газированные напитки: H2CO3 — это соединение, ответственное за характерное шипение газированных напитков, таких как газированные напитки и пиво.
- H2CO3 буферизует pH в различных промышленных процессах, таких как очистка воды и пищевая промышленность.
- Он подавляет огонь, вытесняя кислород и предотвращая возгорание.
- H2CO3 подавляет рост бактерий и плесени в некоторых видах пищевых продуктов, сохраняя их.
- Действует как мягкое чистящее средство, особенно при удалении минеральных отложений.
- Медицинские работники используют H2CO3 в определенных целях, в том числе для лечения определенных поражений кожи и индукции сужения бронхов во время функциональных тестов легких.
- Сварщики используют H2CO3 в качестве защитного газа для предотвращения окисления и получения более чистых сварных швов.
В целом угольная кислота — полезное и универсальное соединение, имеющее широкий спектр применения в различных областях.
Вопросы:
Вопрос: Является ли угольная кислота сильной кислотой?
Ответ: Угольная кислота является слабой кислотой, то есть она лишь частично диссоциирует в воде с образованием ионов водорода (H+) и ионов бикарбоната (HCO3-). Его константа кислотной диссоциации (Ka) относительно низкая, что указывает на то, что он не полностью диссоциирует в воде.
Вопрос: Является ли углекислый газ кислым?
Ответ: Углекислый газ (CO2) по своей природе не является кислотным, поскольку представляет собой нейтральное соединение, которое не образует ионы водорода (H+) в воде. Однако когда CO2 растворяется в воде, он может вступать в реакцию с молекулами воды с образованием угольной кислоты, которая является слабой кислотой. Эта реакция может привести к снижению pH, что сделает раствор более кислым. Следовательно, хотя CO2 сам по себе не является кислым, он может способствовать повышению кислотности раствора при реакции с водой.
