Трифторид азота или NF3 — мощный парниковый газ, используемый в электронной промышленности для плазменного травления и очистки. Он имеет долгую продолжительность жизни в атмосфере и способствует изменению климата.
| Название ИЮПАК | Трифторид азота |
| Молекулярная формула | НФ3 |
| Количество CAS | 7783-54-2 |
| Синонимы | Трифторамин, фторид азота (NF3), фторид азота (1:3), фторид азота (NF3), фторид азота (III), фторид азота, таблетка, ООН 2451 |
| ИнЧИ | ИнЧИ=1S/F3N/c1-4(2)3 |
Молярная масса трифторида азота
Молярная масса NF3 составляет 71,0 г/моль. Это означает, что один моль NF3 содержит 6022 x 10^23 молекул.
Температура кипения трифторида азота
NF3 имеет температуру кипения -129,04°C или -200,27°F. Это относительно мало по сравнению с другими газами, что облегчает обращение с ним в промышленных целях.
Трифторид азота Температура плавления
Трифторид азота имеет температуру плавления -206,73°C или -340,11°F. Это означает, что при комнатной температуре NF3 находится в газообразном состоянии.
Плотность NF3 г/мл
Плотность NF3 составляет 1,88 г/мл при стандартной температуре и давлении. Это означает, что трифторид азота плотнее воздуха и при попадании в атмосферу опустится на землю.
Трифторид азота Молекулярный вес
Молекулярная масса NF3 составляет 71,0 г/моль. Это сумма атомных масс азота и фтора в соединении.
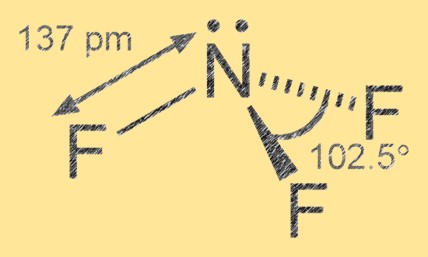
Структура трифторида азота
Трифторид азота имеет тригональную пирамидальную молекулярную геометрию с азотом в качестве центрального атома и тремя атомами фтора, окружающими его. Связь азот-фтор является полярной ковалентной: атомы фтора более электроотрицательны, чем азот, что приводит к частичному отрицательному заряду атомов фтора и частичному положительному заряду атома азота.
Формула трифторида азота
Химическая формула трифторида азота — NF3, что указывает на то, что одна молекула NF3 содержит один атом азота и три атома фтора.
| Появление | Бесцветный газ |
| Удельный вес | 2,62 |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 71,0 г/моль |
| Плотность | 1,88 г/мл при СТП |
| Точка плавления | -206,73°C или -340,11°F |
| Точка кипения | -129,04°C или -200,27°F |
| Мигающая точка | Непригодный |
| Растворимость в воде | 0,41 г/100 мл при 25°C |
| Растворимость | Растворим в органических растворителях |
| Давление газа | 315 кПа при 20°C |
| Плотность пара | 2,01 (воздух = 1) |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность трифторида азота
Трифторид азота (NF3) обычно считается безопасным при правильном обращении, но при неправильном обращении он может представлять собой ряд опасностей. Он может вызвать раздражение кожи и глаз, а вдыхание высоких концентраций может вызвать расстройство дыхания. Газ NF3 может вытеснять кислород в плохо вентилируемых помещениях, что приводит к удушью. Это также мощный парниковый газ, который способствует изменению климата. В случае пожара NF3 может выделять токсичный газообразный фторид водорода. Чтобы избежать этих опасностей, при работе с NF3 важно соблюдать надлежащие протоколы безопасности, включая достаточную вентиляцию и использование защитного оборудования.
| Символы опасности | Т, С |
| Описание безопасности | Избегайте вдыхания и контакта с кожей и глазами. Использовать только в хорошо проветриваемых помещениях. |
| Идентификационные номера ООН | ООН2451 |
| код ТН ВЭД | 28129090 |
| Класс опасности | 2.3 |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза трифторида азота
Существует несколько методов синтеза трифторида азота (NF3):
Распространенный метод включает реакцию безводного аммиака (NH3) с газообразным фтором (F2) в присутствии катализатора, такого как железо, никель или платина. В результате реакции образуются NF3 и фторид водорода (HF). Промышленность обычно использует этот метод для производства NF3.
Другой метод предполагает термическое разложение фторида аммония (NH4F) при высоких температурах. В результате реакции образуется NF3 и газообразный аммиак (NH3). Реакция NH3 с F2 более эффективна, чем этот метод, поэтому применяется реже.
Другой метод включает реакцию оксида азота (NO) с газообразным фтором в присутствии катализатора. В результате реакции образуются газы NF3 и диоксид азота (NO2).
NF3 можно также синтезировать электрохимически, пропуская электрический разряд через смесь газов N2 и F2. В результате плазма образует NF3 и другие азотно-фтористые соединения.
Независимо от используемого метода, крайне важно обращаться с высокореактивными и потенциально опасными реагентами, соблюдая соответствующие меры безопасности. Однако исследователи должны тщательно контролировать процесс синтеза, чтобы обеспечить высокий выход и чистоту конечного продукта.
Использование трифторида азота
Трифторид азота (NF3) благодаря своим уникальным свойствам находит разнообразное промышленное применение.
- Полупроводниковая промышленность использует NF3 в качестве чистящего средства для кремниевых пластин. NF3 также используется в производстве плоских дисплеев, солнечных элементов и микроэлектромеханических систем (МЭМС).
- В производстве электронных компонентов в качестве газа плазменного травления используется NF3. Он проявляет высокую реакционную способность и избирательно удаляет одни материалы, оставляя другие нетронутыми.
- В системах охлаждения также используется NF3 в качестве хладагента из-за его более низкого потенциала глобального потепления, чем у других хладагентов, что делает его более экологически чистым вариантом.
- В аэрокосмической промышленности NF3 используется в качестве топлива из-за его высокого удельного импульса, что обеспечивает эффективную работу космических аппаратов.
Несмотря на многочисленные применения, существуют опасения по поводу воздействия NF3 на окружающую среду. Это мощный парниковый газ с длительным сроком существования в атмосфере. Производство и использование NF3 может способствовать изменению климата, если не будут приняты надлежащие меры предосторожности. Вот почему предпринимаются усилия по сокращению его использования и разработке более устойчивых альтернатив.
Вопросы:
Вопрос: Является ли трифторид азота (NF3) полярным?
О: Да, NF3 полярен. Он имеет тригональную пирамидальную молекулярную геометрию с атомом азота в центре и тремя атомами фтора, расположенными вокруг него. Асимметричная форма молекулы вызывает неравномерное распределение электронной плотности, в результате чего молекула становится полярной.
Вопрос: Какова формула трифторида азота?
Ответ: Формула трифторида азота — NF3, что указывает на то, что молекула состоит из одного атома азота и трех атомов фтора.
Вопрос: Откуда берется трифторид азота?
Ответ: NF3 можно получить различными методами, включая реакцию безводного аммиака с газообразным фтором, термическое разложение фторида аммония и электрохимический синтез. Он обычно используется в полупроводниковой промышленности в качестве чистящего средства, а также при производстве электронных компонентов и аэрокосмических двигателей.
Вопрос: Структура Льюиса трифторида азота?
Ответ: Структура Льюиса NF3 состоит из атома азота, связанного с тремя атомами фтора одинарными ковалентными связями. На атоме азота также имеется пара несвязывающих электронов, придающих молекуле форму тригональной пирамиды.
Вопрос: Межмолекулярные силы трифторида азота?
Ответ: Межмолекулярные силы NF3 включают диполь-дипольные взаимодействия, которые являются результатом полярной природы молекулы. Молекула также испытывает дисперсионные силы Лондона, которые представляют собой слабые межмолекулярные силы, возникающие в результате временных колебаний электронной плотности.
Вопрос: Является ли NF3 полярным или неполярным?
Ответ: NF3 полярен из-за своей асимметричной формы и неравномерного распределения электронной плотности. Молекула имеет дипольный момент, что указывает на то, что она имеет положительный и отрицательный конец, что делает ее полярной молекулой.
