Трибромид бора (BBr3) — химическое соединение, используемое в качестве катализатора в различных реакциях. Он состоит из одного атома бора и трех атомов брома.
| Название ИЮПАК | Трибромид бора |
| Молекулярная формула | ББр3 |
| Количество CAS | 10294-33-4 |
| Синонимы | Трибромборан; бромид бора; бромид бора(III); Бромобор; трибромид бора, [B(Br)3]; Трибромборан |
| ИнЧИ | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Свойства трибромида бора
Формула трибромида бора
Формула бромида бора: BBr3. Он состоит из одного атома бора и трех атомов брома. Это химическое соединение образуется в результате соединения бора и брома.
трибромид бора Молярная масса
Молярную массу бромида бора (BBr3) можно рассчитать путем сложения атомных масс бора и трех атомов брома. Бор имеет атомную массу примерно 10,81 грамма на моль, а атомная масса брома составляет примерно 79,90 грамма на моль. Таким образом, молярная масса BBr3 составляет примерно 250,60 грамм на моль.
Температура кипения трибромида бора
Бромид бора имеет относительно низкую температуру кипения. Он начинает кипеть при температуре около 91 градуса по Цельсию (196 градусов по Фаренгейту). При этой температуре соединение претерпевает фазовый переход из жидкости в газ с выделением паров BBr3.
Трибромид бора Температура плавления
Температура плавления бромида бора относительно высока. Он начинает таять при температуре -46 градусов по Цельсию (-51 градус по Фаренгейту). При этой температуре твердое соединение переходит в жидкое состояние.
Плотность трибромида бора г/мл
Бромид бора имеет плотность примерно 2,63 грамма на миллилитр (г/мл). Эта плотность указывает массу BBr3, присутствующую в одном миллилитре соединения. Это мера компактности или концентрации вещества.
Трибромид бора Молекулярный вес
Молекулярная масса бромида бора (BBr3) рассчитывается путем сложения атомных масс бора и трех атомов брома. Молекулярная масса BBr3 составляет примерно 250,60 грамм на моль.
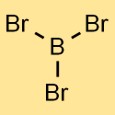
Структура трибромида бора
Структура бромида бора состоит из одного атома бора, связанного с тремя атомами брома. Расположение образует тригональную плоскую геометрию, где атом бора находится в центре, а три атома брома равномерно распределены вокруг него.
Растворимость трибромида бора
Бромид бора — очень реакционноспособное соединение и обычно плохо растворяется в воде. Он имеет тенденцию реагировать с водой с образованием бромистоводородной кислоты и борной кислоты. Однако BBr3 растворим в органических растворителях, таких как хлороформ, четыреххлористый углерод и сероуглерод.
| Появление | Бесцветная жидкость |
| Удельный вес | 2,63 г/мл |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 250,60 г/моль |
| Плотность | 2,63 г/мл |
| Точка плавления | -46°С |
| Точка кипения | 91°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует |
| Растворимость | Растворим в органических растворителях, таких как хлороформ, CCl4 и сероуглерод. |
| Давление газа | 78 мм рт. ст. |
| Плотность пара | 6,52 (воздух=1) |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность трибромида бора
Бромид бора представляет некоторую угрозу безопасности, поэтому при обращении с этим соединением следует соблюдать осторожность. Разъедает кожу, глаза и дыхательную систему. Прямой контакт может вызвать ожоги и сильное раздражение. Вдыхание его паров может вызвать респираторный дискомфорт. Бурно реагирует с водой, выделяя токсичные пары. Поэтому работать с ним следует в хорошо проветриваемом помещении и надевать соответствующие средства индивидуальной защиты, такие как перчатки и очки. Его необходимо хранить вдали от влаги и несовместимых веществ. В случае воздействия необходима немедленная медицинская помощь. Чтобы свести к минимуму риски, связанные с бромидом бора, следует соблюдать соответствующие протоколы и рекомендации по безопасности.
| Символы опасности | Коррозионный, опасен во влажном состоянии. |
| Описание безопасности | Избегайте контакта с кожей, глазами и одеждой. Используйте в хорошо проветриваемом помещении. Наденьте перчатки и защитные очки. |
| Идентификационные номера ООН | ООН3264 |
| код ТН ВЭД | 2811.19.9000 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | Токсично при вдыхании и проглатывании; вызывает серьезные ожоги кожи и повреждения глаз. |
Методы синтеза трибромида бора
Бромид бора можно синтезировать различными методами. Распространенный метод включает реакцию между оксидом бора (B2O3) и бромом (Br2). Реакция протекает в присутствии катализатора, такого как углерод или алюминий, при повышенных температурах. В результате реакции образуется бромид бора и выделяется газообразный кислород.
Другой метод включает реакцию между трихлоридом бора (BCl3) и бромом. Эта реакция протекает при комнатной температуре и в качестве побочных продуктов образует бромид бора и газообразный хлор.
Чтобы получить бромид бора, бор можно ввести в реакцию с избытком брома в контролируемой среде, что требует высоких температур и тщательного контроля условий реакции.
Другой метод заключается в синтезе бромида бора путем взаимодействия гидридов бора, таких как диборан (B2H6) или боран (BH3), с бромистым водородом (HBr). В результате этой реакции в качестве продуктов образуются бромид бора и газообразный водород.
Имейте в виду, что эти методы синтеза требуют осторожности из-за высокой реакционной способности бромида бора. В процессе синтеза следует соблюдать надлежащие протоколы безопасности, такие как ношение соответствующего защитного снаряжения и работа в хорошо проветриваемом помещении.
Использование трибромида бора
Бромид бора (BBr3) имеет несколько важных применений в различных отраслях промышленности. Вот некоторые ключевые приложения:
- Катализатор: BBr3 активно катализирует реакции органического синтеза, обеспечивая такие процессы, как реакции ацилирования, алкилирования и галогенирования.
- Химические промежуточные продукты: BBr3 действует как предшественник при производстве других соединений бора, синтезируя борсодержащие реагенты, бороновые кислоты и полимеры на основе бора.
- Полимеризация: BBr3 активно участвует в реакциях полимеризации, особенно в производстве таких полимеров, как полиэтилен и полипропилен, выступая в качестве катализатора кислоты Льюиса.
- Легирующий агент: полупроводниковая промышленность активно использует BBr3 в качестве легирующего агента, изменяя электрические свойства кремния для его пригодности для использования в электронных устройствах.
- Обнаружение газа: BBr3 активно реагирует с определенными газами, такими как аммиак, что делает его пригодным для детекторов газа и датчиков, используемых в целях обнаружения и мониторинга.
- Лабораторный реагент: BBr3 активно служит реагентом в различных лабораторных экспериментах и исследованиях, проводя реакции бромирования и выступая источником атомов брома в синтетической химии.
- Фармацевтический синтез. Фармацевтическая промышленность активно использует BBr3 в синтезе некоторых лекарств и фармацевтических промежуточных продуктов.
Важно обращаться с бромидом бора осторожно, соблюдая соответствующие протоколы безопасности, из-за его коррозионного и реактивного характера.
Вопросы:
Вопрос: Какой термин описывает реакционную способность трибромида бора (BBr3)?
О: Очень отзывчивый.
Вопрос: Какова формула трибромида бора?
Ответ: Формула бромида бора — BBr3.
Вопрос: Сколько атомов бора содержится в 3,24 грамма трибромида бора?
Ответ: В 3,24 граммах содержится 0,053 моля BBr3, что соответствует 0,159 моля бора, или примерно 9,62 х 10^22 атомов.
Вопрос: Сколько граммов трибромида бора можно получить из 3,49 граммов брома?
A: Молярная масса BBr3 составляет 250,60 г/моль. Так, из около 3,49 грамма брома можно получить около 3,34 грамма бромида бора.
Вопрос: Как называется соединение с формулой BBr3?
Ответ: Соединение формулы BBr3 называется бромидом бора.
Вопрос: Трибромид бора полярный или неполярный?
Ответ: Бромид бора является полярным соединением.
Вопрос: Какова электронная геометрия BBr3?
Ответ: Электронная геометрия BBr3 плоско-тригональная.
Вопрос: Какова структура Льюиса для BBr3?
Ответ: В структуре Льюиса BBr3 в центре находится атом бора, окруженный тремя атомами брома.
Вопрос: Сколько пиков в BBr3?
A: Бромид бора (BBr3) имеет пик в спектре ЯМР.
