Тиосульфат калия (K2S2O3) — химическое соединение, используемое в фотографии в качестве восстановителя и для нейтрализации хлора в плавательных бассейнах. Он имеет белый кристаллический вид и растворим в воде.
| Название ИЮПАК | Тиосульфат калия |
| Молекулярная формула | К2С2О3 |
| Количество CAS | 10294-66-3 |
| Синонимы | Гипосульфит калия, тиосульфат калия, пентагидрат тиосульфата калия, пентагидрат тиосульфата калия, сульфотиоат калия, сульфотиоевая кислота калия |
| ИнЧИ | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Свойства тиосульфата калия
Формула тиосульфата калия
Химическая формула тиосульфата калия (K2S2O3) указывает количество и тип атомов, присутствующих в соединении. Формула состоит из двух атомов калия, двух атомов серы и трех атомов кислорода. Атомы калия имеют положительный заряд, а атомы серы и кислорода — отрицательный.
Молярная масса тиосульфата калия
Молярная масса K2S2O3 составляет 190,33 г/моль. Молярная масса — это масса одного моля вещества, которая рассчитывается путем сложения атомных масс всех атомов в химической формуле. В случае K2S2O3 формула состоит из двух атомов калия, двух атомов серы и трех атомов кислорода.
Температура кипения тиосульфата калия
K2S2O3 не имеет точки кипения, поскольку он разлагается, не достигнув точки кипения. Разложение происходит, когда температура достигает около 100°C и выделяется диоксид серы. Поэтому соединение обычно не используется при высоких температурах.
Температура плавления тиосульфата калия
Температура плавления K2S2O3 составляет 48,3°С. Эта температура относительно низкая по сравнению с другими химическими соединениями. При нагревании до этой температуры твердое вещество K2S2O3 превратится в жидкость.
Плотность тиосульфата калия г/мл
Плотность K2S2O3 составляет 1,667 г/мл. Плотность – это мера количества массы, содержащейся в определенном объеме. Это значение означает, что один миллилитр K2S2O3 имеет массу 1,667 грамма.
Молекулярный вес тиосульфата калия
Молекулярная масса K2S2O3 составляет 190,33 г/моль. Молекулярная масса – это сумма атомных масс всех атомов соединения. Его часто используют для преобразования молей и граммов вещества.
Структура тиосульфата калия
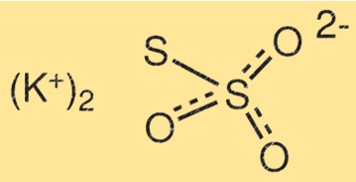
Структура K2S2O3 состоит из двух атомов калия, двух атомов серы и трех атомов кислорода. Атомы серы соединены друг с другом двойной связью, а другой атом серы связан с одним из атомов кислорода. Атомы калия связаны с остальными атомами кислорода.
Растворимость тиосульфата калия
K2S2O3 хорошо растворим в воде, растворимость 432 г/л при 20°C. Это делает его эффективным соединением для очистки воды и в качестве фотографического фиксатора. Однако он не растворяется в органических растворителях, таких как этанол или ацетон.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1667 |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 190,33 г/моль |
| Плотность | 1667 г/мл |
| Точка плавления | 48,3°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим (432 г/л при 20°C) |
| Растворимость | Нерастворим в органических растворителях |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | 6,0 – 9,0 (5% водный раствор) |
Безопасность и опасность тиосульфата калия
K2S2O3 обычно считается безопасным в обращении и использовании при соблюдении надлежащих мер предосторожности. Однако важно знать о некоторых потенциальных опасностях, связанных с этим соединением. Воздействие пыли или паров K2S2O3 может вызвать раздражение глаз, кожи и дыхательных путей. Проглатывание соединения также может вызвать тошноту, рвоту и диарею. Кроме того, контакт с соединением может вызвать у некоторых людей дерматит или повышенную чувствительность кожи. Как и в случае с любым химическим веществом, при обращении с K2S2O3 важно соблюдать надлежащие протоколы безопасности, чтобы избежать воздействия и снизить риск несчастных случаев.
| Символы опасности | XI |
| Описание безопасности | S22 – Не дышать пылью. S24/25 – Избегать попадания на кожу и в глаза. S37/39 – Надевайте подходящие перчатки и средства защиты глаз/лица. |
| Идентификационные номера ООН | ООН 3077 |
| код ТН ВЭД | 2832.10.00 |
| Класс опасности | 9 – Разные опасные материалы |
| Группа упаковки | III |
| Токсичность | LD50 (перорально, крыса): 2500 мг/кг. |
Методы синтеза тиосульфата калия
K2S2O3 можно синтезировать различными методами, в том числе реакцией серы с сульфитом калия в присутствии гидроксида щелочного металла.
Другой метод включает реакцию гидроксида калия с серой и сернистым газом. В результате этой реакции в качестве побочных продуктов образуются K2S2O3 и сульфат калия .
Альтернативный метод синтеза включает реакцию сульфита калия с тиосульфатом натрия в водном растворе. Полученный осадок можно отфильтровать и промыть до получения чистого K2S2O3.
Чтобы получить K2S2O3 в лаборатории, можно провести реакцию гидроксида калия с серой, а затем добавить в смесь сернистый газ. Полученный продукт представляет собой белое кристаллическое твердое вещество, которое можно дополнительно очистить перекристаллизацией.
Использование тиосульфата калия
K2S2O3 имеет несколько важных применений в различных отраслях промышленности. Вот некоторые из наиболее распространенных применений:
- Фотография: Тиосульфат калия используется в качестве фиксирующего агента при обработке фотографий для удаления неиспользованных галогенидов серебра и предотвращения выцветания изображения.
- Сельское хозяйство: Тиосульфат калия используется в качестве удобрения для обеспечения растений серой и калием, которые являются важными питательными веществами для роста и развития.
- Очистка воды: Тиосульфат калия используется для удаления хлора из воды плавательных бассейнов и спа, а также для нейтрализации воздействия хлора при очистке промышленных сточных вод.
- Аналитическая химия: Тиосульфат калия используется в аналитической химии в качестве восстановителя для определения концентрации йода и других окислителей.
- Медицинское лечение: Тиосульфат калия использовался в некоторых медицинских целях, например, при лечении отравления цианидами.
- Промышленное применение: Тиосульфат калия используется в различных отраслях промышленности, таких как гальваника, дубление кожи и добыча нефти.
Вопросы:
Вопрос: Как определить, является ли что-то восстановителем тиосульфата калия?
Ответ: K2S2O3 является восстановителем, поскольку он способен отдавать электроны другим молекулам или ионам, снижая их степень окисления.
Вопрос: Что делает тиосульфат калия восстановителем?
Ответ: K2S2O3 имеет атом серы с более низкой степенью окисления, чем сульфат, что позволяет ему отдавать электроны другим молекулам или ионам и действовать как восстановитель.
Вопрос: Сжигает ли тиосульфат калия зеленые овощи?
О: Нет, К2С2О3 зелень не сжигает. Это белое кристаллическое твердое вещество, не имеющее зеленой окраски.
Вопрос: Какова молярная растворимость AgCl в 1,0 М K2S2O3?
A: Молярная растворимость AgCl в 1,0 М K2S2O3 зависит от различных факторов, таких как температура и ионная сила. Точное значение невозможно определить без дополнительной информации.
Вопрос: Каков заряд или степень окисления K в 2 (K2S2O3)?
A: Заряд или степень окисления K в 2 (K2S2O3) равна +1.
Вопрос: Какова степень окисления S в K2S2O3?
A: Степень окисления S в K2S2O3 равна +2.
Вопрос: Сколько молекул содержится в 4 молях K2S2O3?
Ответ: В 4 молях K2S2O3 содержится примерно 4 x 6,022 x 10^23 молекул K2S2O3, что эквивалентно 2,409 x 10^24 молекул.
Вопрос: Сколько стоят 4 моля K2S2O3?
Ответ: Массу 4 молей K2S2O3 можно рассчитать, умножив молярную массу K2S2O3 (190,31 г/моль) на 4, что соответствует 761,24 грамма. Следовательно, 4 моля K2S2O3 равны 761,24 грамма.
