Тетрафторэтилен или C2F4 — это бесцветный газ без запаха, используемый в производстве фторполимеров, таких как тефлон. Он также используется в производстве хладагентов и пропеллентов.
| Название ИЮПАК | Тетрафторэтилен |
| Молекулярная формула | C2F4 |
| Количество CAS | 116-14-3 |
| Синонимы | ТФЭ, перфторэтилен, этен, тетрафтор-, F4E, фреон 1113, галогенуглерод 1113 |
| ИнЧИ | ИнЧИ=1S/C2F4/c3-1(4)2(5)6 |
Структура Льюиса C2F4
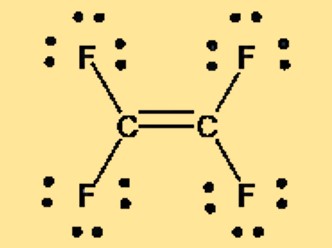
Структура Льюиса тетрафторэтилена, также известного как TFE или C2F4, может быть представлена двумя атомами углерода, дважды связанными друг с другом, причем каждый атом углерода связан с двумя атомами фтора. Структура Льюиса показывает расположение валентных электронов в молекуле и предоставляет информацию о связи и геометрии молекулы. Неполярная природа ТФЭ также очевидна в его структуре Льюиса, в которой нет разделения зарядов или суммарного дипольного момента.
Молярная масса of тетрафторэтилен
Молярная масса тетрафторэтилена, также называемого ТФЭ или C2F4, составляет 100,02 г/моль. Это значение рассчитывается путем сложения атомных масс всех элементов, присутствующих в молекуле, а именно двух атомов углерода и четырех атомов фтора. Молярная масса является важным параметром при определении количества вещества, присутствующего в данном объеме или массе, а также используется в стехиометрических расчетах.
Температура кипения тетрафторэтилена
Тетрафторэтилен имеет температуру кипения -76,3°C (-105,34°F) при стандартном давлении. Это очень летучий газ, который может быстро испаряться при комнатной температуре и атмосферном давлении. Низкая температура кипения ТФЭ делает его идеальным для различных промышленных применений, например, в холодильных системах и в качестве пропеллента для аэрозолей.
Температура плавления тетрафторэтилена
Тетрафторэтилен не имеет четкой точки плавления, поскольку он подвергается фазовому переходу непосредственно из твердого состояния в газообразное, минуя жидкую фазу. Однако твердая форма ТФЭ может существовать при температуре ниже -76,3°C в условиях высокого давления. Твердая форма ТФЭ также очень нестабильна и реакционноспособна и может самопроизвольно полимеризоваться или разлагаться.
Плотность тетрафторэтилена г/мл
Плотность тетрафторэтилена при стандартной температуре и давлении (СТП) составляет 1,47 г/л. Однако, поскольку ТФЭ является газом, его плотность может значительно меняться при изменении температуры и давления. При комнатной температуре и атмосферном давлении плотность ТФЭ составляет примерно 3,21 г/л.
Молекулярный вес тетрафторэтилена
Молекулярная масса C2F4 составляет 100,02 г/моль. Это значение рассчитывается путем сложения атомных весов всех атомов, присутствующих в молекуле. ТФЭ имеет относительно низкую молекулярную массу, что способствует его высокой летучести и низкой температуре кипения.
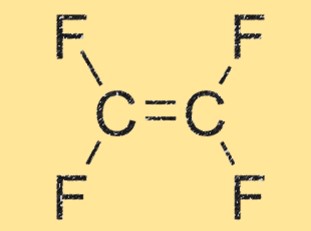
Структура C2F4
C2F4 имеет линейную структуру: два атома углерода связаны друг с другом двойной связью, каждый из которых связан с двумя атомами фтора. Молекула очень симметрична и не имеет суммарного дипольного момента, что делает ее неполярной. Линейная геометрия ТФЭ также способствует его высокой реакционной способности и способности образовывать полимерные цепи.
Формула C2F4
Химическая формула C2F4 — C2F4, что указывает на то, что молекула содержит два атома углерода и четыре атома фтора. Формула предоставляет информацию о типах и количестве атомов, присутствующих в молекуле, что может быть полезно для прогнозирования ее химического поведения и реакций.
| Появление | Бесцветный газ |
| Удельный вес | 1,47 г/л при СТП |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 100,02 г/моль |
| Плотность | 3,21 г/л при комнатной температуре и атмосферном давлении |
| Точка плавления | Не имеет четко выраженной точки плавления. |
| Точка кипения | -76,3°C (-105,34°F) при стандартном давлении |
| Мигающая точка | Неприменимо, поскольку ТФЭ является газом. |
| Растворимость в воде | нерастворимый |
| Растворимость | Растворим в некоторых органических растворителях, таких как ацетон и хлороформ. |
| Давление газа | 209,7 кПа при 20°C |
| Плотность пара | 2,95 (воздух = 1) |
| пКа | Не применимо, поскольку ТФЭ не является ни кислотой, ни основанием. |
| рН | Не применимо, поскольку ТФЭ не является ни кислотой, ни основанием. |
Безопасность и опасность тетрафторэтилена
Тетрафторэтилен может представлять собой ряд рисков для безопасности и здоровья при неправильном обращении. Воздействие высоких концентраций ТФЭ может вызвать раздражение глаз, кожи и дыхательных путей. Длительное воздействие также может привести к повреждению легких, включая отек легких и пневмонию. ТФЭ также является горючим газом, который может образовывать взрывоопасные смеси с воздухом. Поэтому его необходимо хранить и транспортировать в специализированных контейнерах во избежание риска возгорания или взрыва. При работе с ТФЭ важно использовать соответствующие средства защиты, в том числе средства защиты органов дыхания, чтобы предотвратить воздействие и свести к минимуму риск неблагоприятных последствий для здоровья.
| Символы опасности | F+ (легковоспламеняющийся) |
| Описание безопасности | Легковоспламеняющийся газ. Вызывает серьезное раздражение глаз. Может вызвать раздражение дыхательных путей. |
| Идентификационные номера ООН | ООН1080 |
| код ТН ВЭД | 2903,39 |
| Класс опасности | 2.1 (Горючий газ) |
| Группа упаковки | Неприменимо, поскольку ТФЭ является газом. |
| Токсичность | ТФЭ имеет низкую острую токсичность, но длительное воздействие может привести к повреждению легких и другим неблагоприятным последствиям для здоровья. ТФЭ также считается потенциальным канцерогеном для человека. |
Методы синтеза тетрафторэтилена
Тетрафторэтилен (ТФЭ) можно синтезировать несколькими методами, включая термическое и каталитическое разложение различных фторуглеродных соединений.
Распространенным методом синтеза ТФЭ является термическое разложение хлордифторметана (CCl2F2) в присутствии подходящего инициатора при высокой температуре. Процесс включает разрыв связей углерод-хлор в CCl2F2 с образованием радикала, который затем реагирует с другими молекулами с образованием ТФЭ.
Другим методом является каталитическое разложение фторуглеродных соединений, таких как гексафторпропен (HFP) или октафторциклобутан (OFCB), на подходящем катализаторе, таком как хлорид алюминия или пентафторид сурьмы, при высокой температуре. Этот метод позволяет получить смесь ТФЭ и других побочных фторуглеродных продуктов, которые затем разделяют и очищают.
Кроме того, ТФЭ можно синтезировать путем электрохимического фторирования — процесса, который включает пропускание смеси водорода и газообразного фтора через металлический анод в присутствии электролита. Этот метод позволяет получить смесь ТФЭ и других фторированных соединений, которые затем разделяют и очищают.
В целом, синтез ТФЭ требует специального оборудования и опыта из-за высокой реакционной способности и опасной природы используемых химических веществ. Поэтому важно следовать надлежащим протоколам и правилам безопасности при синтезе ТФЭ.
Использование тетрафторэтилена
Тетрафторэтилен (ТФЭ) — универсальное химическое вещество, имеющее несколько промышленных и коммерческих применений.
- Одним из основных применений ТФЭ является использование в качестве мономера для производства политетрафторэтилена (ПТФЭ), антипригарного термостойкого полимера, широко известного как тефлон.
- ТФЭ служит сырьем для производства других фторированных соединений, таких как перфторированные карбоновые кислоты и перфторалкилсульфонаты, которые находят применение в электронной, текстильной и других отраслях промышленности.
- ТФЭ играет решающую роль в производстве фторполимеров, таких как поливинилиденфторид (ПВДФ), которые широко используются в покрытиях, трубах и проводах из-за их высокой химической стойкости и долговечности.
- Производители используют ТФЭ в качестве хладагента в системах кондиционирования и охлаждения, а также при производстве пеноизоляционных материалов.
- Фармацевтическая промышленность использует ТФЭ в качестве растворителя и пропеллента для аэрозольных составов.
- ТФЭ имеет множество применений, включая покрытие кухонной посуды, электроизоляцию и высокоэффективные прокладки.
В целом, универсальность и уникальные свойства ТФЭ делают его ценным химическим веществом в широком спектре промышленных и коммерческих применений. Тем не менее, важно соблюдать надлежащие протоколы и правила техники безопасности при обращении с ТФЭ, чтобы свести к минимуму риск неблагоприятных последствий для здоровья и ущерба окружающей среде.
Вопросы:
Какие атомные или гибридные орбитали образуют сигма-связь между c2 и f в тетрафторэтилене, c2f4?
Сигма-связь между C2 и F в тетрафторэтилене (C2F4) образуется за счет перекрывания гибридных орбиталей. В C2F4 каждый атом углерода находится в состоянии sp2-гибридизации, что означает, что три его атомные орбитали (одна 2s-орбиталь и две 2p-орбитали) объединяются, образуя три sp2-гибридизированные орбитали, расположенные в тригональной плоской геометрии. Каждый атом углерода также имеет негибридизованную 2p-орбиталь, перпендикулярную плоскости sp2-орбиталей.
Атом фтора имеет одну занятую 2p-орбиталь, которая перекрывается с негибридизованной 2p-орбиталью соседнего атома углерода, образуя сигма-связь. Это перекрытие происходит между двумя атомами встык, что приводит к линейному расположению атомов в молекуле. Электроны сигма-связи в основном расположены в области между двумя ядрами, создавая прочную ковалентную связь между атомами углерода и фтора.
Тефлон производят из полимеризованного тетрафторэтилена?
Да, тефлон производится полимеризацией тетрафторэтилена (ТФЭ). ТФЭ представляет собой бесцветный газ без запаха, который можно полимеризовать в присутствии катализатора с образованием политетрафторэтилена (ПТФЭ), широко известного как тефлон.
Процесс полимеризации включает инициирование реакции с использованием свободнорадикального инициатора, такого как персульфат аммония или азобисизобутиронитрил (АИБН), который генерирует свободные радикалы, инициирующие цепную реакцию мономеров ТФЭ, полимеризующихся в ПТФЭ.
