Сульфит калия (K2SO3) – химическое соединение, состоящее из калия, серы и кислорода. Его обычно используют в качестве консерванта в пищевой промышленности для предотвращения обесцвечивания и порчи.
| Название ИЮПАК | Сульфит калия |
| Молекулярная формула | К2SO3 |
| Количество CAS | 10117-38-1 |
| Синонимы | дикалия сульфит; Двухкалиевая соль сернистой кислоты; сульфонат калия; Оксид серы и калия |
| ИнЧИ | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Сульфит калия
Формула сульфита калия
Сульфит калия имеет химическую формулу K2SO3, которая указывает на то, что он содержит два атома калия, один атом серы и три атома кислорода. Соединение образуется в результате реакции гидроксида калия (KOH) и диоксида серы (SO2). Сульфит калия является ионным соединением, то есть он состоит из положительно заряженных ионов калия и отрицательно заряженных ионов сульфита. Формула сульфит-иона: SO32-.
сульфит калия Молярная масса
Молярная масса K2SO3 составляет 158,26 г/моль. Это рассчитывается путем сложения атомных масс каждого элемента по формуле (2 х атомная масса K) + атомная масса S + (3 х атомная масса O). Молярная масса соединения важна, поскольку она помогает рассчитать количество соединения, необходимое для данной реакции, или определить концентрацию раствора.
Температура кипения сульфита калия
K2SO3 не имеет определенной температуры кипения, поскольку он разлагается до достижения точки кипения. Однако при нагревании K2SO3 подвергается термическому разложению с образованием сульфата калия (K2SO4) и диоксида серы (SO2). Температура разложения составляет примерно 390°C.
Температура плавления сульфита калия
Температура плавления K2SO3 составляет около 350°C. При этой температуре твердое соединение превращается в жидкость. Однако при повышении температуры K2SO3 разлагается, как уже говорилось ранее.
Плотность сульфита калия г/мл
Плотность K2SO3 составляет 2,44 г/мл при комнатной температуре. Плотность определяется как масса вещества в единице объема. Высокая плотность K2SO3 указывает на то, что это относительно тяжелое соединение. Это свойство важно при определении физических свойств соединения, таких как его растворимость и реакционная способность.
Молекулярный вес сульфита калия
Молекулярная масса K2SO3 составляет 158,26 г/моль. Это значение представляет собой среднюю массу молекулы соединения. Молекулярный вес важен для расчета количества вещества в заданном объеме или массе, что полезно в химических реакциях и лабораторных экспериментах.
Структура сульфита калия
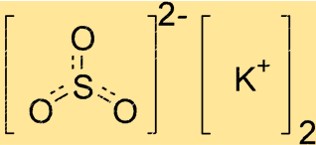
K2SO3 имеет кристаллическую структуру, то есть его атомы расположены повторяющимся образом. Соединение имеет тригональную плоскую геометрию с атомом серы в центре и тремя атомами кислорода, расположенными симметрично вокруг него. Ионы калия располагаются вне этой структуры, уравновешивая отрицательный заряд сульфит-ионов.
Растворимость сульфита калия
K2SO3 хорошо растворим в воде. При комнатной температуре он может растворяться в воде с образованием прозрачного бесцветного раствора. Растворимость K2SO3 обусловлена его ионной природой, которая позволяет ему диссоциировать в воде на составляющие его ионы. На растворимость K2SO3 также влияет температура, причем растворимость увеличивается с повышением температуры.
| Появление | Белый кристаллический порошок |
| Удельный вес | 2.44 |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 158,26 г/моль |
| Плотность | 2,44 г/мл |
| Точка плавления | 350°С |
| Точка кипения | Разлагается при 390°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим в воде |
| Растворимость | Растворим в этаноле и глицерине. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 10,3 (для сернистой кислоты) |
| рН | ~9 (для 0,1 М раствора) |
Сульфит калия: безопасность и опасности
K2SO3 относительно безопасен в обращении и использовании, если приняты надлежащие меры предосторожности. Однако он может представлять опасность, если с ним не обращаться осторожно. Соединение может вызвать раздражение кожи, глаз и дыхательной системы при контакте с этими частями тела. K2SO3 также может вызвать проблемы с желудочно-кишечным трактом при проглатывании. Кроме того, соединение представляет потенциальную опасность пожара и взрыва при воздействии тепла или пламени. Поэтому при работе с K2SO3 следует принимать соответствующие меры безопасности, такие как ношение защитных средств и хранение соединения вдали от источников тепла и источников возгорания.
| Символы опасности | Череп и кости |
| Описание безопасности | Токсично, вредно при проглатывании, раздражает кожу и глаза. |
| Идентификационные номера ООН | ООН 2697 |
| код ТН ВЭД | 283210 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II (Средняя опасность) |
| Токсичность | Перорально (LD50): 345 мг/кг (крыса) |
Методы синтеза сульфита калия
K2SO3 можно синтезировать разными методами, в том числе реакцией гидроксида калия с диоксидом серы или серы, реакцией карбоната калия с диоксидом серы, реакцией бисульфита калия с гидроксидом. калий.
В первом методе раствор гидроксида калия реагирует с сернистым газом в присутствии воды с образованием K2SO3. Во втором методе смесь карбоната калия и диоксида серы нагревают до высоких температур с получением K2SO3. Третий метод предполагает смешивание бисульфита калия с гидроксидом калия с получением K2SO3 и воды.
Другим распространенным методом синтеза K2SO3 является реакция диоксида серы с калиевой солью, например хлоридом калия, в присутствии восстановителей, таких как гидросульфит натрия или сульфат железа (II). Этот метод часто используется в промышленных условиях для производства больших количеств K2SO3.
Использование сульфита калия
K2SO3 благодаря своим химическим свойствам находит применение в различных отраслях промышленности. Вот некоторые распространенные варианты использования K2SO3:
- Пищевая промышленность и производство напитков: используется в качестве пищевого консерванта для предотвращения порчи и изменения цвета таких продуктов, как вино, сухофрукты и креветки.
- Фотография: используется в качестве средства фиксации фотографий, чтобы предотвратить дальнейшее проявление пленки и сделать изображение постоянным.
- Очистка воды: используется в качестве восстановителя для удаления хлора из воды и очистки сточных вод.
- Бумажная промышленность: используется в качестве отбеливателя для удаления примесей и отбеливания целлюлозы в процессе производства бумаги.
- Текстильная промышленность: используется в качестве восстановителя для удаления излишков красителя с тканей и для отбеливания текстиля.
- Химическая промышленность: используется в качестве восстановителя в химических реакциях для преобразования окислителей в восстановители.
- Лекарственная промышленность: используется в некоторых медицинских целях для предотвращения или облегчения симптомов определенных состояний.
Вопросы:
Вопрос: Какова формула сульфита калия?
Ответ: Формула сульфита калия: K2SO3.
Вопрос: Является ли сульфат калия сульфитом?
Ответ: Нет, сульфат калия не является сульфитом. Это соль калия, серы и кислорода с химической формулой K2SO4.
Вопрос: Какая соль образуется при реакции H2SO4 с NaOH? К2SO3, Na2SO4, Na2SO3, K2SO4
Ответ: Когда H2SO4 реагирует с NaOH, образуется соль Na2SO4.
Вопрос: Сколько ионов SO32 содержится в 99,6 мг Na2SO3?
Молярная масса Na2SO3 составляет 126,05 г/моль. Ответ: Чтобы рассчитать количество ионов SO32-, нам сначала нужно найти количество молей Na2SO3: 99,6 мг/126,05 г/моль = 0,000789 моль. Так как Na2SO3 содержит два иона SO32- на молекулу, то число ионов SO32- в 0,000789 моль Na2SO3 составляет 0,000789 моль x 2 = 0,00158 моль. Следовательно, в 99,6 мг Na2SO3 содержится 0,00158 моль x 6,022 x 10^23 ионов/моль = 9,52 x 10^20 ионов SO32-.
Вопрос: Сколько ионов натрия содержится в 99,6 мг Na2SO3? Молярная масса Na2SO3 составляет 126,05 г/моль.
Ответ: Чтобы рассчитать количество ионов натрия, нам сначала нужно найти количество молей Na2SO3: 99,6 мг/126,05 г/моль = 0,000789 моль. Поскольку каждая молекула Na2SO3 содержит два иона натрия, количество ионов натрия в 0,000789 молях Na2SO3 составляет 0,000789 моль х 2 = 0,00158 моль. Следовательно, в 99,6 мг Na2SO3 содержится 0,00158 моль x 6,022 x 10^23 ионов/моль = 9,52 x 10^20 ионов натрия.
Вопрос: Каково химическое название Na2SO3?
Ответ: Химическое название Na2SO3 — сульфит натрия.
Вопрос: Как называется соединение формулы Na2SO3?
Ответ: Название соединения формулы Na2SO3 — сульфит натрия.
