Сульфат натрия представляет собой белое кристаллическое соединение формулы Na2SO4. Он используется в моющих средствах, бумажной и стекольной промышленности в качестве наполнителя, осушителя и пеногасителя.
| Название ИЮПАК | Сульфат динатрия |
| Молекулярная формула | Na2SO4 |
| Количество CAS | 7757-82-6 |
| Синонимы | Сульфат натрия, сульфат натрия безводный, сульфат натрия |
| ИнЧИ | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 Молярная масса
Сульфат натрия имеет молярную массу 142,04 г/моль. Это ионное соединение, состоящее из двух катионов натрия (Na+) и сульфат-аниона (SO42-). Молярная масса рассчитывается путем сложения атомных масс всех атомов молекулы сульфата натрия. В данном случае мы имеем два атома натрия массой 22,99 г/моль каждый, один атом серы массой 32,06 г/моль и четыре атома кислорода массой 15,99 г/моль каждый. Сложив их вместе, мы получим молярную массу сульфата натрия.
Температура кипения сульфата натрия
Сульфат натрия имеет высокую температуру кипения 1429 ° C (2604 ° F). Это связано с ионной природой соединения, которая создает сильные электростатические силы притяжения между положительно заряженными ионами натрия и отрицательно заряженными ионами сульфата. Для преодоления этих сил требуется большое количество энергии, поэтому температура кипения сульфата натрия так высока.
Температура плавления сульфата натрия
Температура плавления сульфата натрия варьируется в зависимости от содержания в нем воды. Безводный сульфат натрия (без воды) имеет температуру плавления 884°C (1623°F). Однако декагидрат сульфата натрия (с десятью молекулами воды) плавится при более низкой температуре — 32,4°C (90,3°F). Присутствие молекул воды в кристаллической структуре декагидрата сульфата натрия ослабляет ионные связи между ионами натрия и сульфата, снижая температуру плавления.
Плотность сульфата натрия г/мл
Плотность сульфата натрия варьируется в зависимости от его формы. Сульфат натрия безводный имеет плотность 2,664 г/см3, а декагидрат сульфата натрия имеет плотность 1,464 г/см3. Разница в плотности обусловлена наличием в кристаллической структуре декагидрата молекул воды, что увеличивает его объем и уменьшает плотность.
Молекулярный вес сульфата натрия
Молекулярная масса сульфата натрия составляет 142,04 г/моль. Это масса молекулы сульфата натрия, состоящей из двух ионов натрия и одного иона сульфата.
Структура сульфата натрия
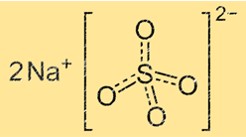
Сульфат натрия имеет кристаллическую структуру, состоящую из повторяющихся звеньев ионов натрия и сульфата. Сульфат-ион представляет собой тетраэдр с четырьмя атомами кислорода по углам и одним атомом серы в центре. Ион натрия представляет собой небольшую сферу, расположенную между сульфат-ионами. Кристаллическая структура сульфата натрия может меняться в зависимости от содержания в нем воды. Безводный сульфат натрия имеет иную кристаллическую структуру, чем декагидрат сульфата натрия.
Формула сульфата натрия
Химическая формула сульфата натрия: Na2SO4. Это означает, что каждая молекула сульфата натрия содержит два иона натрия (Na+) и один сульфат-ион (SO42-). Формула представляет собой простейшее целочисленное соотношение атомов в молекуле соединения.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2664 г/см3 (безводный), 1464 г/см3 (декагидрат) |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 142,04 г/моль |
| Плотность | 2664 г/см3 (безводный), 1464 г/см3 (декагидрат) |
| Точка плавления | 884°C (безводный), 32,4°C (декагидрат) |
| Точка кипения | 1429°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | 44,1 г/100 мл (безводный), 47,6 г/100 мл (декагидрат) |
| Растворимость | Растворим в воде, нерастворим в этаноле. |
| Давление газа | 0,01 мм рт.ст. при 20°C |
| Плотность пара | Непригодный |
| пКа | 1-й: 2.01, 2-й: 7.20, 3-й: 9.41 |
| рН | 9-11 (10% раствор) |
Безопасность и опасность сульфата натрия
Сульфат натрия обычно считается безопасным в использовании, но при определенных обстоятельствах может вызвать раздражение или повреждение. Он может вызвать раздражение кожи, глаз и дыхательной системы при контакте или вдыхании. Проглатывание больших количеств может вызвать тошноту, рвоту и диарею. Он также может быть вредным для водной флоры и фауны, если попадет в водные пути. Сульфат натрия не считается легковоспламеняющимся или взрывоопасным материалом. Однако при нагревании или воздействии высоких температур он может выделять токсичные пары. Важно соблюдать надлежащие процедуры обращения, носить защитное оборудование и хранить сульфат натрия в безопасном и надежном месте.
| Символы опасности | Никто |
| Описание безопасности | S24/25: Избегать попадания на кожу и в глаза. S36/37: Носить соответствующую защитную одежду и перчатки. |
| Идентификационные номера ООН | ООН 2118 |
| код ТН ВЭД | 2833.11.00 |
| Класс опасности | Безопасно |
| Группа упаковки | Непригодный |
| Токсичность | LD50 (перорально, крыса): 5900 мг/кг. |
Методы синтеза сульфата натрия
Существуют различные методы синтеза сульфата натрия, включая реакцию хлорида натрия с серной кислотой или реакцию гидроксида натрия с серной кислотой.
Для производства сульфата натрия в результате реакции хлорида натрия и серной кислоты образуется сульфат натрия и газообразный хлороводород. Этот процесс сводит к минимуму вредные испарения за счет проведения экзотермической реакции в контролируемых условиях. Впоследствии раствор подвергается фильтрации перед выпариванием с получением кристаллов сульфата натрия.
Синтез сульфата натрия также включает объединение серной кислоты и гидроксида натрия с образованием сульфата натрия и воды. Реакция экзотермическая и требует осторожного обращения во избежание перелива. После фильтрования смеси полученный раствор подвергают выпариванию с получением кристаллов сульфата натрия.
Другой метод включает реакцию карбоната натрия с серной кислотой с образованием сульфата натрия, воды и углекислого газа. Этот метод требует использования вытяжного шкафа из-за выделения токсичных паров. Затем раствор фильтруют и выпаривают с получением кристаллов сульфата натрия.
Другие промышленные процессы, такие как производство вискозы, моющих средств и стекла, также производят сульфат натрия в качестве побочного продукта. В результате этих процессов в качестве отходов образуется сульфат натрия, который можно очистить и повторно использовать для других целей.
Применение сульфата натрия
Сульфат натрия имеет широкий спектр применения в различных отраслях промышленности, в том числе:
- Моющие средства: используются в качестве наполнителя в порошкообразных моющих средствах, помогая увеличить объем и улучшить текучесть продукта.
- Стекло: используется в качестве флюса при производстве стекла, помогает снизить температуру плавления и улучшить прозрачность конечного продукта.
- Текстиль: используется при производстве синтетических волокон, таких как вискоза, для повышения прочности и долговечности материала.
- Бумага: используется в качестве целлюлозного агента при производстве бумаги, помогая расщеплять древесные волокна и удалять примеси.
- Пищевые продукты: используется в качестве пищевой добавки, в первую очередь в качестве загустителя и эмульгатора в обработанных пищевых продуктах.
- Фармацевтические препараты: используются при производстве некоторых лекарств, например слабительных, для лечения запоров.
- Химические вещества: используются в производстве различных химикатов, включая сульфид натрия, силикат натрия и бикарбонат натрия.
- Водоочистка: используется на водоочистных станциях для удаления ионов кальция и магния из жесткой воды.
- Бурение нефтяных скважин: используется при бурении нефтяных скважин в качестве утяжелителя, помогая контролировать плотность бурового раствора.
Вопросы:
Вопрос: Какова формула сульфата натрия?
Ответ: Химическая формула сульфата натрия: Na2SO4.
Вопрос: Что такое сульфат натрия?
Ответ: Сульфат натрия представляет собой белое кристаллическое твердое вещество, обычно используемое в различных отраслях промышленности, включая моющие средства, стекло, текстиль, бумагу и продукты питания.
Вопрос: Сульфат натрия является кислым или основным?
A: Сульфат натрия не является ни кислотным, ни основным; это нейтральное соединение.
Вопрос: Какого цвета сульфат натрия? Ответ: Сульфат натрия представляет собой белое кристаллическое вещество и, следовательно, бесцветен.
