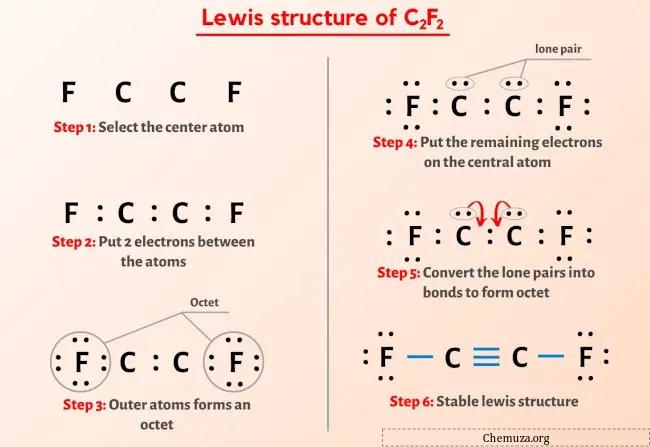
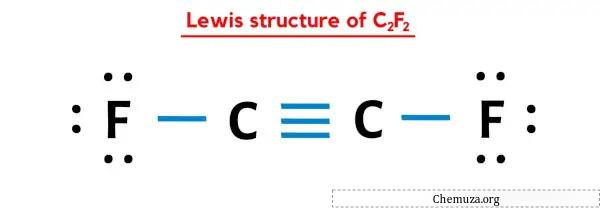
Итак, вы уже видели изображение выше, верно?
Позвольте мне кратко объяснить изображение выше.
Структура Льюиса C2F2 имеет тройную связь между двумя атомами углерода (C) и одинарную связь между атомом углерода (C) и атомами фтора (F). У двух атомов фтора (F) есть 3 неподеленные пары.
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса C2F2, оставайтесь со мной, и вы получите подробное пошаговое объяснение того, как нарисовать структуру Льюиса C2F2 .
Итак, давайте перейдем к этапам рисования структуры Льюиса C2F2.
Шаги по рисованию структуры Льюиса C2F2
Шаг 1: Найдите общее количество валентных электронов в молекуле C2F2.
Чтобы найти общее количество валентных электронов в молекуле C2F2, сначала необходимо знать, сколько валентных электронов присутствует в атоме углерода, а также в атоме фтора.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны углерода, а также фтора с помощью таблицы Менделеева.
Сумма валентных электронов в молекуле C2F2
→ Валентные электроны, отдаваемые атомом углерода:
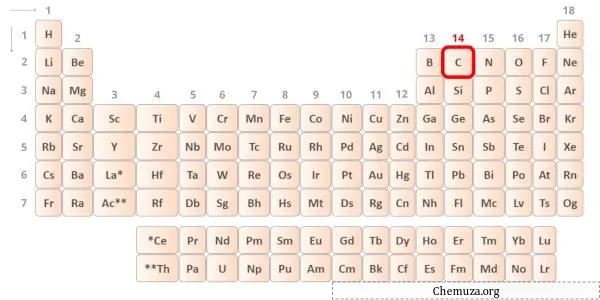
Углерод — элемент 14-й группы таблицы Менделеева. [1] Следовательно, валентные электроны, присутствующие в углероде, равны 4 .
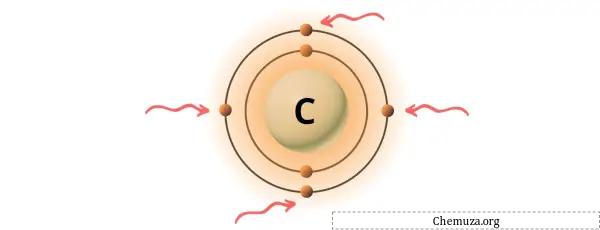
Вы можете увидеть 4 валентных электрона, присутствующих в атоме углерода, как показано на изображении выше.
→ Валентные электроны, отдаваемые атомом фтора:
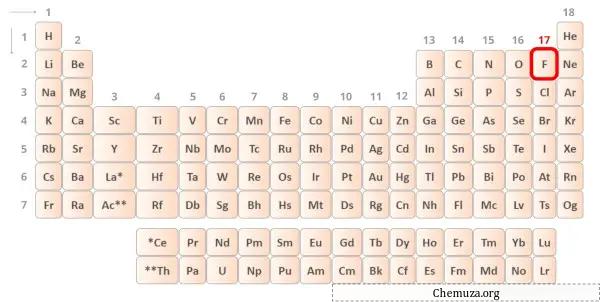
Флюорит — элемент 17 группы таблицы Менделеева. [2] Следовательно, валентный электрон, присутствующий во флюорите, равен 7 .
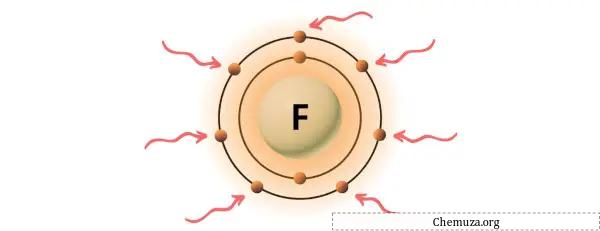
Вы можете увидеть семь валентных электронов, присутствующих в атоме фтора, как показано на изображении выше.
Так,
Общее количество валентных электронов в молекуле C2F2 = валентные электроны, подаренные 2 атомами углерода + валентные электроны, подаренные 2 атомами фтора = 4(2) + 7(2) = 22 .
Шаг 2: Выберите центральный атом
Чтобы выбрать центральный атом, надо помнить, что в центре остается наименее электроотрицательный атом.
Здесь данная молекула — C2F2 и содержит атомы углерода (C) и атомы фтора (F).
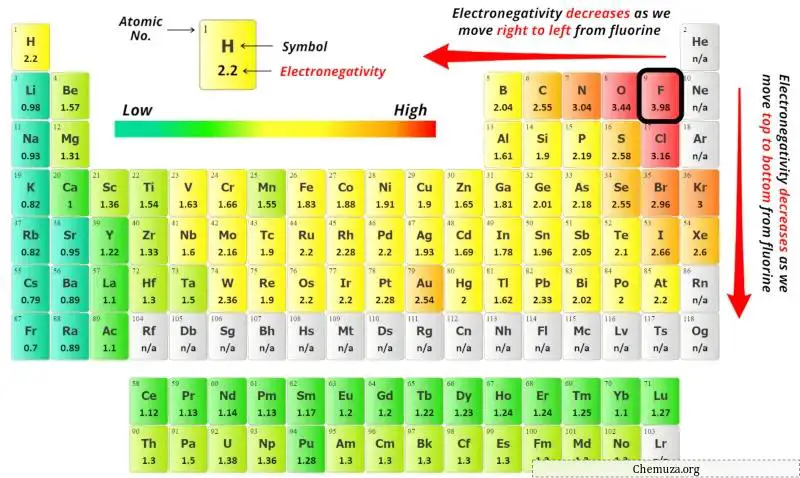
Значения электроотрицательности атома углерода (C) и атома фтора (F) вы можете увидеть в таблице Менделеева выше.
Если сравнить значения электроотрицательности углерода (С) и фтора (F), то атом углерода менее электроотрицательен .
Здесь атомы углерода (C) являются центральным атомом, а атомы фтора (F) — внешними атомами.
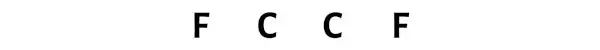
Шаг 3: Соедините каждый атом, поместив между ними пару электронов.
Теперь в молекуле C2F2 нужно разместить пары электронов между атомами углерод-углерод и между атомами углерод-фтор.
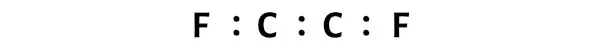
Это указывает на то, что эти атомы химически связаны друг с другом в молекуле C2F2.
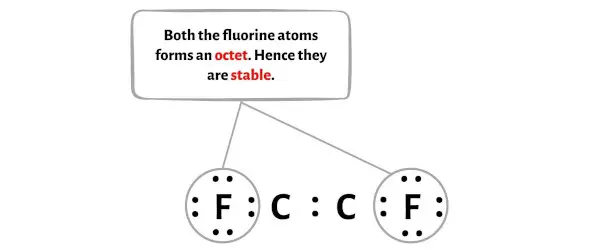
Шаг 4: Сделайте внешние атомы стабильными. Поместите оставшуюся пару валентных электронов на центральный атом.
На этом этапе вам необходимо проверить стабильность внешних атомов.
Здесь на эскизе молекулы C2F2 видно, что внешние атомы — это атомы фтора.
Эти внешние атомы фтора образуют октет и поэтому стабильны.
Дополнительно на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле C2F2.
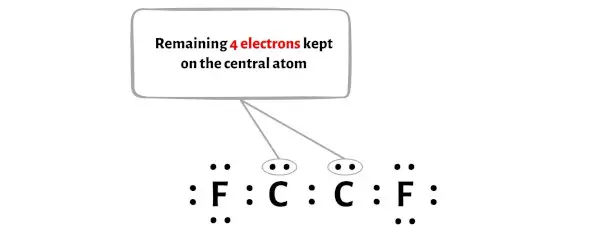
Молекула C2F2 имеет всего 22 валентных электрона , из них на диаграмме выше используются только 18 валентных электронов .
Таким образом, количество оставшихся электронов = 22 – 18 = 4 .
Вам нужно разместить эти 4 электрона на двух центральных атомах углерода на диаграмме молекулы C2F2 выше.
Теперь перейдем к следующему шагу.
Шаг 5: Проверьте октет центрального атома. Если в нем нет байта, преобразуйте неподеленную пару в двойную или тройную связь.
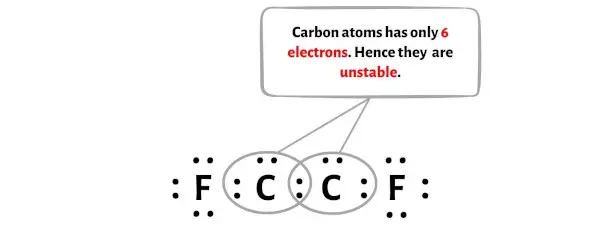
На этом этапе вам нужно проверить, стабильны ли центральные атомы углерода (С).
Чтобы проверить стабильность центральных атомов углерода (С), нам нужно проверить, образуют ли они октет или нет.
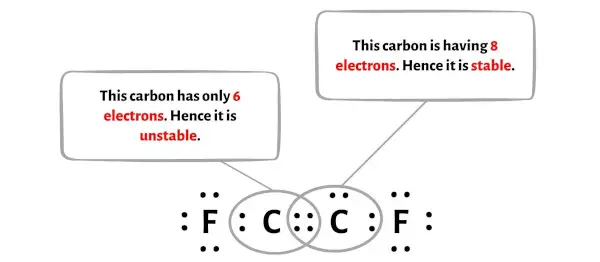
К сожалению, два атома углерода здесь не образуют октет. Два атома углерода имеют всего 6 электронов и нестабильны.
Теперь, чтобы сделать атом углерода стабильным, вам необходимо преобразовать неподеленную пару в двойную связь, чтобы атом углерода мог иметь 8 электронов (т.е. один октет).
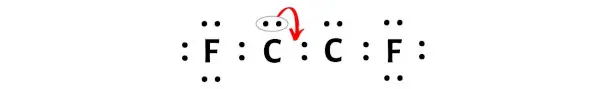
Но после преобразования пары электронов один атом углерода образует октет, а другой атом углерода все еще не образует октет, поскольку у него всего 6 электронов.
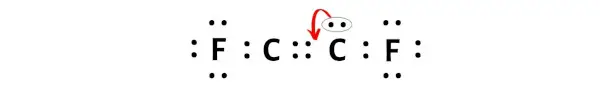
Опять же, нам нужно преобразовать дополнительную пару электронов, чтобы образовать тройную связь.
После преобразования этой пары электронов в тройную связь центральный атом углерода получит еще 2 электрона, и таким образом его общее количество электронов станет 8.
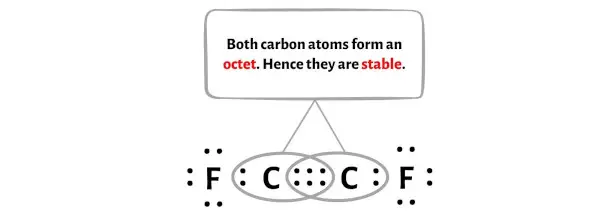
На изображении выше вы можете видеть, что два атома углерода образуют октет.
И поэтому эти атомы углерода стабильны.
Теперь перейдем к последнему шагу, чтобы проверить, стабильна ли структура Льюиса C2F2 или нет.
Шаг 6: Проверьте стабильность структуры Льюиса
Теперь вы подошли к последнему шагу, на котором вам необходимо проверить стабильность структуры Льюиса C2F2.
Устойчивость структуры Льюиса можно проверить, используя формальное понятие заряда .
Короче говоря, теперь нам нужно найти формальный заряд атомов углерода (C), а также атомов фтора (F), присутствующих в молекуле C2F2.
Для расчета формального налога необходимо использовать следующую формулу:
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы C2F2 на изображении ниже.
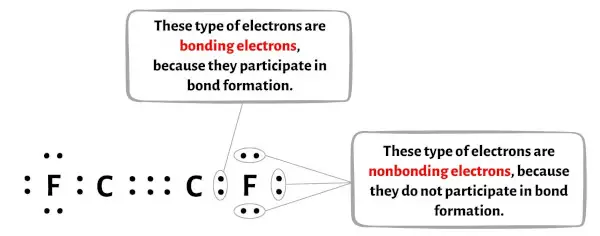
Для атома углерода (С):
Валентные электроны = 4 (потому что углерод находится в группе 14)
Связывающие электроны = 8
Несвязывающие электроны = 0
Для атома флюорита (F):
Валентные электроны = 7 (потому что фтор находится в 17-й группе)
Связывающие электроны = 2
Несвязывающие электроны = 6
| Официальное обвинение | «=» | валентные электроны | – | (Связывание электронов)/2 | – | Несвязывающие электроны | ||
| ПРОТИВ | «=» | 4 | – | 8/2 | – | 0 | «=» | 0 |
| Ф | «=» | 7 | – | 2/2 | – | 6 | «=» | 0 |
Из приведенных выше расчетов формального заряда вы можете видеть, что атомы углерода (C), а также атомы фтора (F) имеют «нулевой» формальный заряд.
Это указывает на то, что указанная выше структура Льюиса C2F2 стабильна и дальнейших изменений в указанной выше структуре C2F2 нет.
В приведенной выше точечной структуре Льюиса C2F2 вы также можете представить каждую пару связывающих электронов (:) как одинарную связь (|). Это приведет к следующей структуре Льюиса C2F2.
Надеюсь, вы полностью поняли все шаги, описанные выше.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
