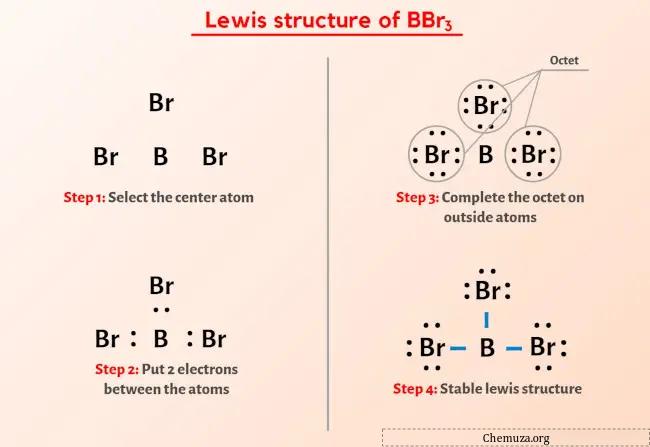
Итак, вы уже видели изображение выше, верно?
Позвольте мне кратко объяснить изображение выше.
Структура Льюиса BBr3 имеет атом бора (B) в центре, окруженный тремя атомами брома (Br). Между атомом бора (B) и каждым атомом брома (Br) имеется три одинарные связи.
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса BBr3, оставайтесь со мной, и вы получите подробное пошаговое объяснение рисования структуры ЛьюисаBBr3 .
Итак, давайте перейдем к этапам рисования структуры Льюиса BBr3.
Шаги по рисованию структуры Льюиса BBr3
Шаг 1: Найдите общее количество валентных электронов в молекуле BBr3.
Для того чтобы найти общее количество валентных электронов в молекуле BBr3 , сначала необходимо знать, сколько валентных электронов имеется в атоме бора, а также в атоме брома.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны бора, а также брома с помощью таблицы Менделеева.
Сумма валентных электронов в молекуле BBr3
→ Валентные электроны, отдаваемые атомом бора:
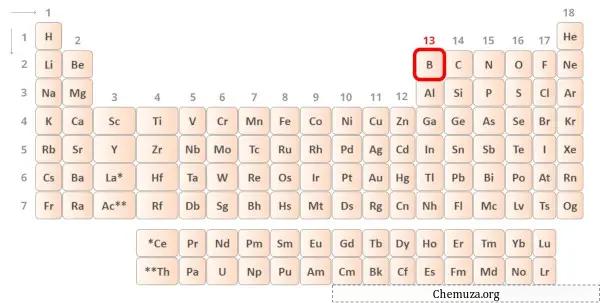
Бор — элемент 13-й группы таблицы Менделеева. [1] Следовательно, валентные электроны, присутствующие в боре, равны 3 .

Вы можете увидеть три валентных электрона, присутствующие в атоме бора, как показано на изображении выше.
→ Валентные электроны, отдаваемые атомом брома:
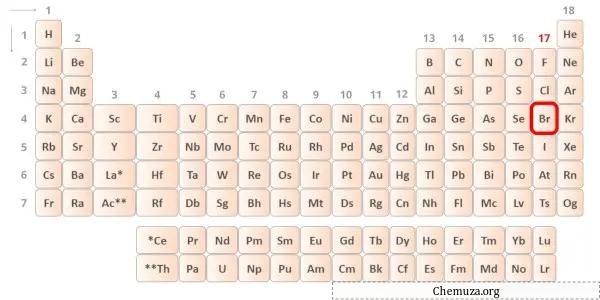
Бром — элемент 17 группы таблицы Менделеева.[2] Следовательно, валентные электроны, присутствующие в броме, равны 7 .
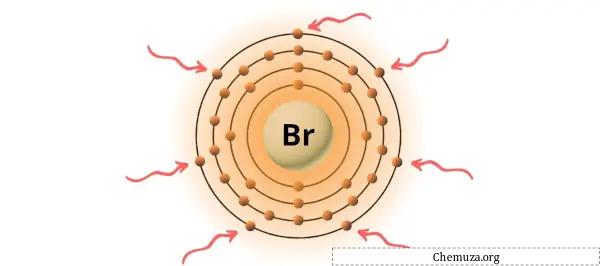
Вы можете увидеть семь валентных электронов, присутствующих в атоме брома, как показано на изображении выше.
Так,
Общее количество валентных электронов в молекуле BBr3 = валентные электроны, пожертвованные 1 атомом бора + валентные электроны, подаренные 3 атомами брома = 3 + 7(3) = 24 .
Шаг 2: Выберите центральный атом
Чтобы выбрать центральный атом, надо помнить, что в центре остается наименее электроотрицательный атом.
Здесь данная молекула — BBr3 и содержит атомы бора (B) и атомы брома (Br).
Значения электроотрицательности атома бора (B) и атома брома (Br) вы можете увидеть в таблице Менделеева выше.
Если сравнить значения электроотрицательности бора (B) и брома (Br), то атом бора менее электроотрицательен .
Здесь атом бора (B) является центральным атомом, а атомы брома (Br) — внешними атомами.
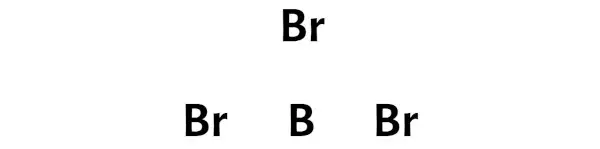
Шаг 3: Соедините каждый атом, поместив между ними пару электронов.
Теперь в молекуле BBr3 нужно разместить электронные пары между атомом бора (B) и атомами брома (Br).
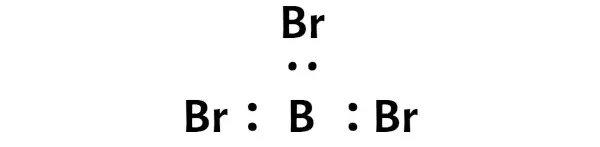
Это указывает на то, что бор (B) и бром (Br) химически связаны друг с другом в молекуле BBr3.
Шаг 4: Сделайте внешние атомы стабильными
На этом этапе вам необходимо проверить стабильность внешних атомов.
Здесь на эскизе молекулы BBr3 видно, что внешние атомы — это атомы брома.
Эти внешние атомы брома образуют октет и поэтому стабильны.
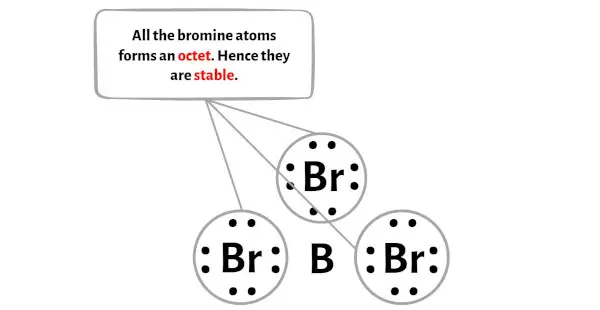
Дополнительно на этапе 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле BBr3.
Молекула BBr3 имеет в общей сложности 24 валентных электрона , и все эти валентные электроны используются на приведенной выше диаграмме BBr3.
Следовательно, больше нет пар электронов, которые можно было бы удерживать на центральном атоме.
Итак, теперь давайте перейдем к следующему шагу.
Шаг 5: Проверьте стабильность структуры Льюиса
Теперь вы подошли к последнему шагу, на котором вам необходимо проверить стабильность структуры Льюиса BBr3.
Устойчивость структуры Льюиса можно проверить, используя формальное понятие заряда .
Короче говоря, теперь нам нужно найти формальный заряд атомов бора (B), а также атомов брома (Br), присутствующих в молекуле BBr3.
Для расчета формального налога необходимо использовать следующую формулу:
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы BBr3 на изображении ниже.
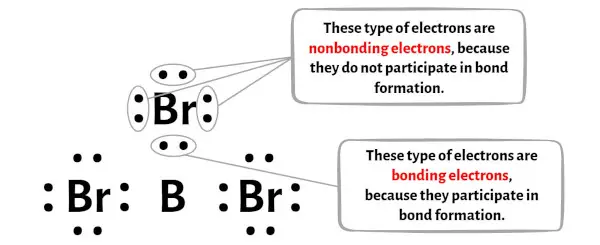
Для атома бора (В):
Валентные электроны = 3 (потому что бор находится в группе 13)
Связывающие электроны = 6
Несвязывающие электроны = 0
Для атома брома (Br):
Валентный электрон = 7 (потому что бром находится в группе 17)
Связывающие электроны = 2
Несвязывающие электроны = 6
| Официальное обвинение | «=» | валентные электроны | – | (Связывание электронов)/2 | – | Несвязывающие электроны | ||
| Б | «=» | 3 | – | 6/2 | – | 0 | «=» | 0 |
| Бр | «=» | 7 | – | 2/2 | – | 6 | «=» | 0 |
Из приведенных выше расчетов формального заряда видно, что атом бора (B), а также атом брома (Br) имеют «нулевой» формальный заряд.
Это указывает на то, что указанная выше структура Льюиса BBr3 стабильна и в указанной выше структуре BBr3 больше нет изменений.
В приведенной выше точечной структуре Льюиса BBr3 вы также можете представить каждую пару связывающих электронов (:) как одинарную связь (|). В результате будет получена следующая структура Льюиса BBr3.
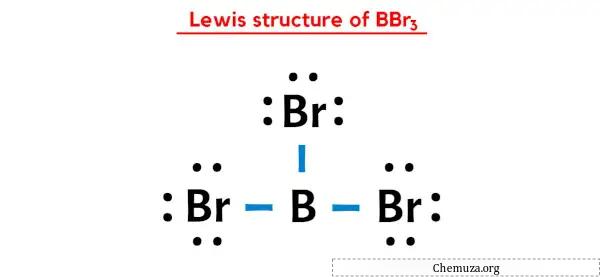
Надеюсь, вы полностью поняли все шаги, описанные выше.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
