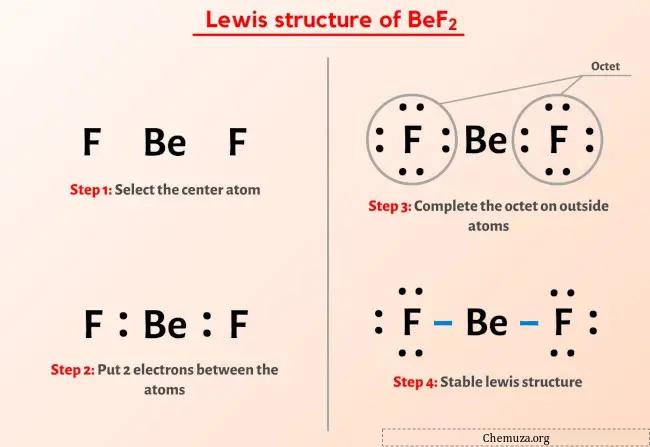
Итак, вы уже видели изображение выше, верно?
Позвольте мне кратко объяснить изображение выше.
Структура Льюиса BeF2 имеет в центре атом бериллия (Be), окруженный двумя атомами фтора (F). Между атомом бериллия (Be) и каждым атомом фтора (F) имеются две одинарные связи. У двух атомов фтора (F) есть 3 неподеленные пары.
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса BeF2 (дифторид бериллия), то оставайтесь со мной, и вы получите подробное пошаговое объяснение рисования структуры Льюиса BeF2 .
Итак, перейдем к этапам рисования структуры Льюиса BeF2.
Шаги по рисованию структуры Льюиса BeF2
Шаг 1: Найдите общее количество валентных электронов в молекуле BeF2.
Чтобы найти общее количество валентных электронов в молекуле BeF2 (дифторида бериллия), сначала необходимо узнать количество валентных электронов, присутствующих в атоме бериллия, а также в атоме фтора.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны бериллия, а также фтора с помощью таблицы Менделеева .
Сумма валентных электронов в молекуле BeF2
→ Валентные электроны, отдаваемые атомом бериллия:
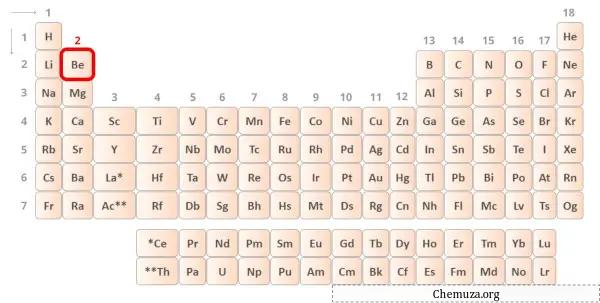
Бериллий — элемент 2 группы таблицы Менделеева. [1] Следовательно, валентные электроны, присутствующие в бериллии, равны 2 .
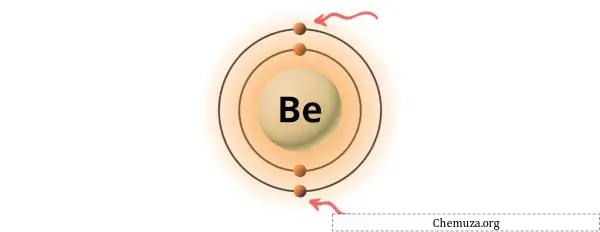
Вы можете увидеть два валентных электрона, присутствующие в атоме бериллия, как показано на изображении выше.
→ Валентные электроны, отдаваемые атомом фтора:
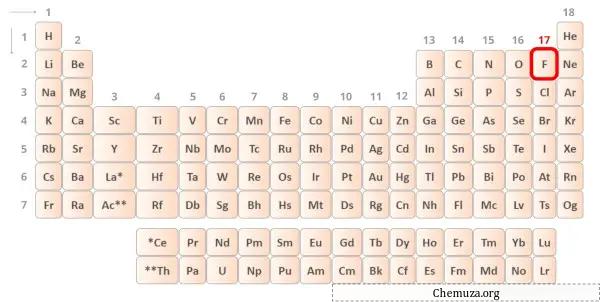
Флюорит — элемент 17 группы таблицы Менделеева. [2] Следовательно, валентный электрон, присутствующий во флюорите, равен 7 .
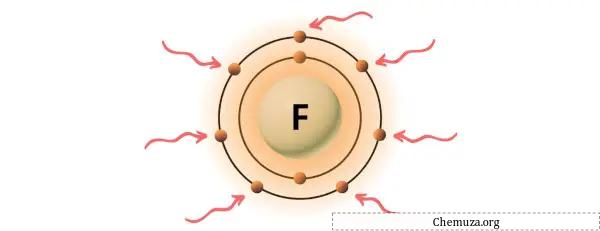
Вы можете увидеть семь валентных электронов, присутствующих в атоме фтора, как показано на изображении выше.
Так,
Общее количество валентных электронов в молекуле BeF2 = валентные электроны, подаренные 1 атомом бериллия + валентные электроны, подаренные 2 атомами фтора = 2 + 7(2) = 16 .
Шаг 2: Выберите центральный атом
Чтобы выбрать центральный атом, надо помнить, что в центре остается наименее электроотрицательный атом.
Здесь данная молекула представляет собой BeF2 (дифторид бериллия) и содержит атомы бериллия (Be) и атомы фтора (F).
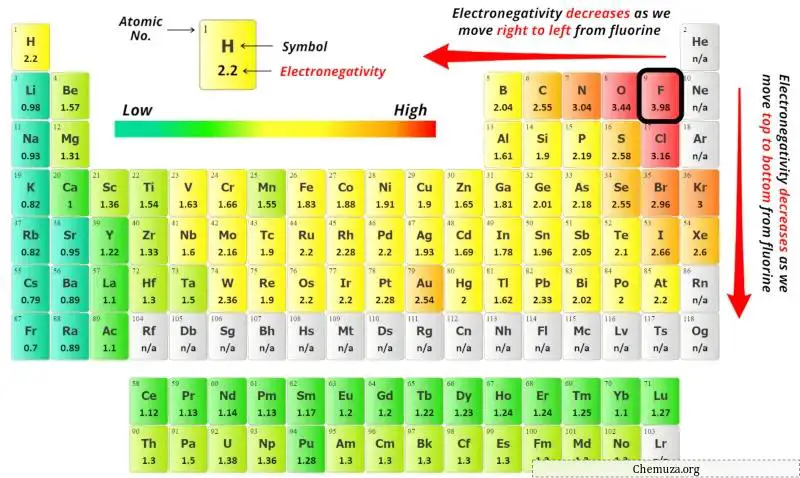
Значения электроотрицательности атома бериллия (Be) и атома фтора (F) вы можете увидеть в таблице Менделеева выше.
Если сравнить значения электроотрицательности бериллия (Be) и фтора (F), то атом бериллия менее электроотрицательен .
Здесь атом бериллия (Be) является центральным атомом, а атомы фтора (F) — внешними атомами.

Шаг 3: Соедините каждый атом, поместив между ними пару электронов.
Теперь в молекуле BeF2 мы должны разместить электронные пары между атомом бериллия (Be) и атомами фтора (F).

Это указывает на то, что бериллий (Be) и фтор (F) химически связаны друг с другом в молекуле BeF2.
Шаг 4: Сделайте внешние атомы стабильными
На этом этапе вам необходимо проверить стабильность внешних атомов.
Здесь на эскизе молекулы BeF2 видно, что внешние атомы — это атомы фтора.
Эти внешние атомы фтора образуют октет и поэтому стабильны.
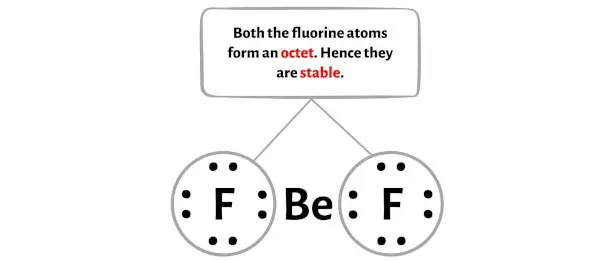
Дополнительно на этапе 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле BeF2.
Молекула BeF2 имеет в общей сложности 16 валентных электронов , и все эти валентные электроны используются в приведенной выше диаграмме BeF2.
Следовательно, больше нет пар электронов, которые можно было бы удерживать на центральном атоме.
Итак, теперь давайте перейдем к следующему шагу.
Шаг 5: Проверьте стабильность центрального атома
На этом этапе вам необходимо проверить, стабилен ли центральный атом бериллия (Be) или нет.
Теперь бериллию нужно всего 4 электрона, чтобы стать стабильным. S-орбитали бериллия полностью заполнены этими четырьмя электронами.
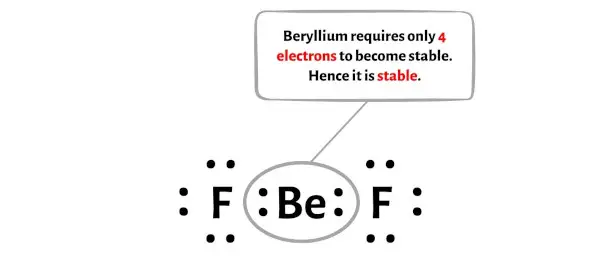
На изображении выше вы можете видеть, что атом бериллия имеет 4 электрона и поэтому стабилен.
Теперь перейдем к последнему шагу: проверим, стабильна или нет структура Льюиса BeF2.
Шаг 6: Проверьте стабильность структуры Льюиса
Теперь вы подошли к последнему шагу, на котором вам необходимо проверить стабильность льюисовской структуры BeF2.
Устойчивость структуры Льюиса можно проверить, используя формальное понятие заряда .
Короче говоря, теперь нам необходимо найти формальный заряд атомов бериллия (Be), а также атомов фтора (F), присутствующих в молекуле BeF2.
Для расчета формального налога необходимо использовать следующую формулу:
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы BeF2 на изображении ниже.
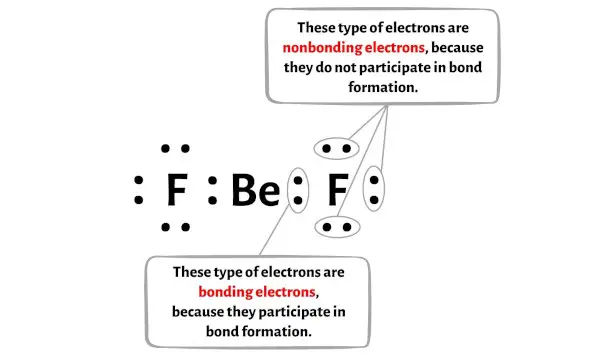
Для атома бериллия (Be):
Валентные электроны = 2 (поскольку бериллий находится во 2-й группе)
Связывающие электроны = 4
Несвязывающие электроны = 0
Для атома флюорита (F):
Электронная валентность = 7 (потому что фтор находится в группе 17)
Связывающие электроны = 2
Несвязывающие электроны = 6
| Официальное обвинение | «=» | валентные электроны | – | (Связывание электронов)/2 | – | Несвязывающие электроны | ||
| Быть | «=» | 2 | – | 4/2 | – | 0 | «=» | 0 |
| Ф | «=» | 7 | – | 2/2 | – | 6 | «=» | 0 |
Из приведенных выше расчетов формального заряда видно, что атом бериллия (Be), а также атом фтора (F) имеют «нулевой» формальный заряд.
Это указывает на то, что указанная выше структура Льюиса BeF2 стабильна и дальнейших изменений в указанной выше структуре BeF2 нет.
В приведенной выше точечной структуре Льюиса BeF2 вы также можете представить каждую пару связывающих электронов (:) как одинарную связь (|). Это приведет к следующей структуре Льюиса BeF2.

Надеюсь, вы полностью поняли все шаги, описанные выше.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
