Серная кислота (H2SO4) или купоросное масло — это очень агрессивная и сильная минеральная кислота, обычно используемая в различных промышленных процессах, таких как производство удобрений, нефтепереработка и обработка металлов. Это также мощное обезвоживающее средство.
| Название ИЮПАК | Серная кислота |
| Молекулярная формула | H2SO4 |
| Количество CAS | 7664-93-9 |
| Синонимы | Купоросное масло, ангидрид серной кислоты, бисерная кислота |
| ИнЧИ | ИнХI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/п-1 |
Свойства серной кислоты
Формула серной кислоты
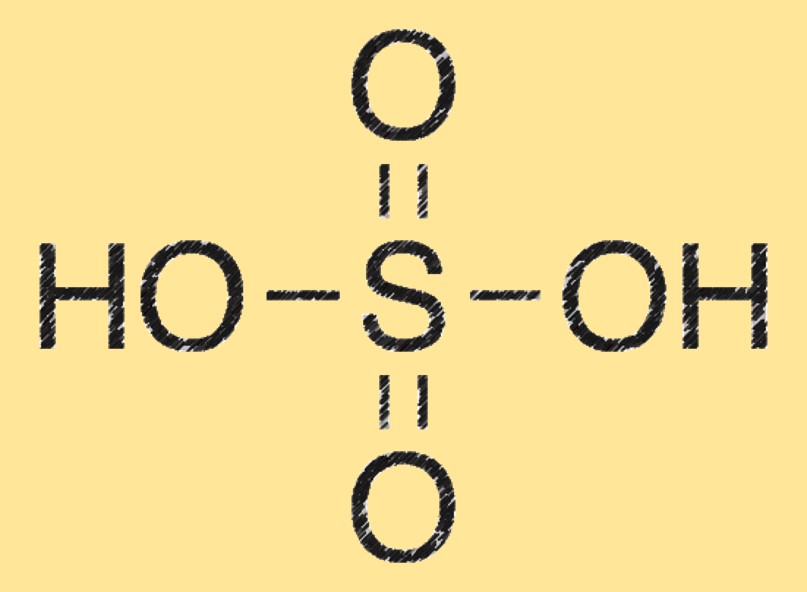
Химическая формула серной кислоты — H2SO4, которая представляет собой два атома водорода, один атом серы и четыре атома кислорода. Эта формула представляет состав молекулы серной кислоты и ее химическую структуру.
Молярная масса of Серная кислота
Молярная масса серной кислоты составляет 98,08 г/моль. Его рассчитывают путем сложения атомных масс каждого элемента в химической формуле серной кислоты (H2SO4).
Температура кипения серной кислоты
Серная кислота имеет температуру кипения 337,1°С. При этой температуре давление паров жидкости достигает атмосферного давления и она начинает кипеть.
Температура плавления серной кислоты
Температура плавления серной кислоты составляет 10,4°С. Это очень вязкая жидкость при комнатной температуре, но при более низких температурах она может замерзнуть и перейти в твердое состояние.
Плотность серной кислоты г/мл
Плотность серной кислоты варьируется от 1,84 г/мл до 1,93 г/мл в зависимости от ее концентрации. По мере увеличения концентрации серной кислоты увеличивается и ее плотность.
Молекулярный вес серной кислоты
Молекулярная масса серной кислоты составляет 98,08 г/моль. Он рассчитывается путем сложения атомных масс каждого элемента в его химической формуле (H2SO4).
Структура серной кислоты
Молекула серной кислоты состоит из двух атомов водорода (H), связанных с атомом серы (S), также связанным с четырьмя атомами кислорода (O). Он имеет тетраэдрическую молекулярную геометрию и является мощным дегидратирующим агентом.
| Появление | Прозрачная, бесцветная, маслянистая жидкость |
| Удельный вес | 1,84 (вода = 1) |
| Цвет | Бесцветный |
| Запах | Резкий и сернистый запах |
| Молярная масса | 98,079 г/моль |
| Плотность | 1835 г/мл |
| Точка плавления | 10,5°С |
| Точка кипения | 337°С |
| Мигающая точка | 140°Ф (60°С) |
| Растворимость в воде | Полностью смешивается |
| Растворимость | Растворим в воде и спирте |
| Давление газа | 40 мм рт.ст. (20°С) |
| Плотность пара | 2,5 (воздух = 1) |
| пКа | -3 |
| рН | Менее 1 (сильно кислая) |
Безопасность и опасность серной кислоты
Серная кислота – очень агрессивное и опасное вещество. Попадание на кожу и в глаза может вызвать серьезные ожоги и слепоту. Вдыхание его паров может раздражать дыхательную систему и вызывать кашель, хрипы и одышку. Он легковоспламеняющийся и реактивный, с ним следует обращаться с осторожностью в хорошо проветриваемом помещении, используя защитное оборудование, такое как перчатки и средства защиты глаз. Разливы следует немедленно убирать, чтобы не повредить поверхности и не нанести вред людям. Для обеспечения безопасного обращения необходимы правильное хранение и маркировка.
| Символы опасности | Коррозионный, Раздражающий, Вредный |
| Описание безопасности | Храните вдали от источников тепла/искры/открытого огня/горячих поверхностей. Курение запрещено. Хранить в хорошо проветриваемом помещении. Держите контейнер плотно закрытым. Надевайте защитные перчатки/защитную одежду/защиту глаз/лица. |
| Идентификационные номера ООН | ООН1830 |
| код ТН ВЭД | 2815.11.00 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | Перорально: LD50 = 1,2 г/кг (Крыса) |
Методы синтеза серной кислоты
H2SO4 можно синтезировать несколькими методами, включая контактный процесс и процесс в мастер-камере.
Контактный процесс — наиболее широко используемый метод промышленного производства серной кислоты, который включает окисление диоксида серы до триоксида серы и последующую реакцию триоксида серы с водой с образованием H2SO4.
С другой стороны, процесс в свинцовой камере включает окисление диоксида серы диоксидом азота в присутствии катализатора, обычно диоксида свинца, с последующей реакцией полученного триоксида серы с водой. Оба метода позволяют получить H2SO4 разной степени чистоты и концентрации, которую при необходимости можно дополнительно очищать и концентрировать.
Использование серной кислоты
H2SO4 — универсальное химическое вещество, широко используемое в различных отраслях промышленности. Люди обычно используют серную кислоту при производстве удобрений, моющих средств, красителей и пигментов. Он также играет роль в переработке нефтепродуктов, переработке полезных ископаемых и руд, а также производстве химических веществ, таких как азотная кислота и сульфаты. В лабораториях H2SO4 используется в качестве реагента и служит катализатором химических реакций. В свинцово-кислотных аккумуляторах в качестве электролита используется серная кислота, а производители стали используют ее для травления, чтобы удалить ржавчину и окалину перед нанесением покрытия или покраской.
В целом, H2SO4 играет решающую роль во многих промышленных процессах, что делает его одним из наиболее важных химических веществ в мире.
Вопросы:
Серная кислота — сильная кислота?
Да, H2SO4 – сильная кислота. Сильная кислота – это кислота, которая полностью диссоциирует в воде с образованием ионов водорода (H+), то есть отдает все свои ионы водорода раствору. Серная кислота, считающаяся одной из самых сильных кислот, имеет высокий уровень кислотности, что делает ее очень реакционноспособной и коррозионной. Чтобы избежать вреда для людей и окружающей среды, необходимо правильное обращение и хранение серной кислоты.
Для чего используется серная кислота?
Серная кислота широко используется в различных отраслях промышленности и применениях. Некоторые из наиболее распространенных применений H2SO4 включают:
- Производство удобрений: Серная кислота используется при производстве фосфорной кислоты, которая является ключевым компонентом многих удобрений.
- Нефтепереработка: серная кислота используется для удаления примесей, таких как соединения серы, из сырой нефти в процессе переработки.
- Обработка металлов: Серная кислота используется при обработке металлов для удаления ржавчины и окалины с железа и стали, а также для очистки металлических руд.
- Производство: Серная кислота используется в производстве различных продуктов, включая моющие средства, красители, пигменты и другие химические вещества.
- Автомобильные аккумуляторы. Серная кислота используется в качестве электролита в свинцово-кислотных аккумуляторах, обычно используемых в автомобилях и других транспортных средствах.
- Лабораторный реагент: Серная кислота обычно используется в качестве лабораторного реагента из-за ее высокого уровня реакционной способности и способности растворять многие вещества.
Какой кислотой является серная кислота?
H2SO4 – сильная неорганическая кислота. Классифицированная как дипротонная кислота, H2SO4 отдает в раствор два иона водорода (H+), что делает ее сильной минеральной кислотой. Из-за его высокой реакционной способности и коррозионной активности необходимо соблюдать осторожность при обращении и хранении H2SO4, чтобы избежать вреда для людей и окружающей среды. Промышленность широко использует серную кислоту в своих технологических процессах, в том числе при производстве удобрений, моющих средств, красителей, пигментов и других химических веществ, а также при нефтепереработке нефтепродуктов и переработке металлических руд.
Какова формула серной кислоты?
Химическая формула серной кислоты: H2SO4.
Что такое купоросное масло?
Купоросное масло — это еще один термин для обозначения серной кислоты, мощного и очень агрессивного химического вещества. Его обычно используют при производстве удобрений, моющих средств и красителей, а также при нефтепереработке и переработке других химикатов.
