Сульфат серебра (Ag2SO4) — белое твердое вещество, используемое в фотографии и аналитической химии. Он растворяется в воде и при нагревании разлагается на оксид серебра и триоксид серы.
| Название ИЮПАК | Сульфат серебра |
| Молекулярная формула | Ag2SO4 |
| Количество CAS | 10294-26-5 |
| Синонимы | Сульфат серебра, сернокислое серебро, серная кислота серебра, моносульфат дисеребряного серебра. |
| ИнЧИ | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Свойства сульфата серебра
Формула сульфата серебра
Химическая формула диаргента сульфата: Ag2SO4. Он состоит из двух атомов серебра (Ag), связанных с одним атомом серы (S) и четырьмя атомами кислорода (O). Формула представляет соотношение атомов в молекуле дисульфата серебра.
Молярная масса сульфата серебра
Молярную массу сернокислого серебра рассчитывают путем сложения атомных масс составляющих его элементов. Серебро имеет атомную массу 107,87 грамма на моль (г/моль), сера имеет атомную массу 32,07 г/моль, а кислород имеет атомную массу 16,00 г/моль. Сложив их вместе, молярная масса диаргента сульфата составит примерно 311,81 г/моль.
Температура кипения сульфата серебра
Сульфат диаргента не имеет четкой точки кипения, поскольку он разлагается, не достигнув точки кипения. При нагревании он подвергается термическому разложению и распадается на оксид серебра (Ag2O) и триоксид серы (SO3). Следовательно, температура кипения диаргент-сульфата неприменима.
Сульфат серебра. Температура плавления.
Температура плавления диаргента сульфата составляет примерно 652 градуса Цельсия (1206 градусов по Фаренгейту). При этой температуре диаргент-сульфат переходит из твердого состояния в расплавленное жидкое состояние. Важно отметить, что температура плавления может незначительно меняться в зависимости от чистоты образца дисульфата.
Плотность сульфата серебра г/мл
Плотность диаргента сульфата составляет примерно 5,45 грамма на миллилитр (г/мл). Это значение указывает на массу диаргента сульфата в единице объема. Плотность вещества обычно зависит от температуры, поэтому важно учитывать условия при измерении плотности диаргентного сульфата.
Молекулярный вес сульфата серебра
Молекулярную массу диаргента сульфата рассчитывают путем сложения атомных масс входящих в его состав элементов с учетом стехиометрии формулы. В случае дисульфата серебра (Ag2SO4) молекулярная масса составляет примерно 311,81 грамма на моль (г/моль).
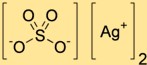
Структура сульфата серебра
Сульфат дисеребра имеет кристаллическую структуру, состоящую из катионов серебра (Ag+) и сульфат-анионов (SO4^2-). Катионы серебра окружены атомами кислорода сульфат-анионов, образуя трехмерную сетку.
Растворимость сульфата серебра
Диаргент сульфат плохо растворяется в воде. Он растворяется в ограниченной степени: около 0,8 грамма растворяется в 100 миллилитрах воды при комнатной температуре. На растворимость могут влиять такие факторы, как температура и присутствие других растворенных веществ в растворе.
| Появление | Белый твердый |
| Удельный вес | Н/Д |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 311,81 г/моль |
| Плотность | 5,45 г/мл |
| Точка плавления | 652°С (1206°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Н/Д |
| Растворимость в воде | Плохо растворим |
| Растворимость | Растворяется в вод. кислоты, спирты, ацетон, эфир, ацетаты, амиды |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Н/Д |
Безопасность и опасность сульфата серебра
Диаргент сульфат представляет собой некоторую угрозу безопасности, поэтому при обращении с ним следует соблюдать осторожность. Важно избегать вдыхания, проглатывания или контакта с кожей и глазами. При работе с диаргентом сульфатом рекомендуется носить соответствующие средства индивидуальной защиты, включая перчатки, очки и лабораторный халат. В случае случайного воздействия тщательно промойте пораженные участки водой. Диаргент сульфат может вызывать раздражение кожи и глаз, а длительное или многократное воздействие может привести к сенсибилизации. Также необходимо обращаться с диаргентом сульфатом в хорошо проветриваемом помещении, чтобы свести к минимуму риск его вдыхания. Для обеспечения безопасности необходимо соблюдать надлежащие процедуры хранения, маркировки и утилизации.
| Символы опасности | Нет символа |
| Описание безопасности | Избегайте вдыхания, проглатывания и контакта с кожей и глазами. Носите средства индивидуальной защиты. Работайте в хорошо проветриваемом помещении. Надлежащее хранение, маркировка и утилизация. |
| Идентификационные номера ООН | Н/Д |
| код ТН ВЭД | 28429090 |
| Класс опасности | Н/Д |
| Группа упаковки | Н/Д |
| Токсичность | Раздражает кожу и глаза. Длительное/повторяющееся воздействие может вызвать сенсибилизацию. |
Методы синтеза сернокислого серебра
Существует несколько методов синтеза диаргент-сульфата.
Распространенный метод включает реакцию между нитратом серебра (AgNO3) и серной кислотой (H2SO4) . В лаборатории, помешивая, ученые медленно добавляют нитрат серебра в раствор серной кислоты, в результате чего образуется белый осадок, называемый диаргентным сульфатом. Осадок собирают, промывают и сушат до получения чистого дисульфата.
Ученые также получают сульфат серебра, добавляя оксид серебра (Ag2O) к серной кислоте и нагревая смесь при перемешивании. В результате этого процесса образуется диаргентный сульфат в виде осадка, который фильтруют, промывают и сушат для получения конечного продукта.
Кроме того, ученые могут получить сульфат серебра, нагревая смесь хлорида серебра (AgCl) и концентрированной серной кислоты. Они добавляют хлорид серебра к серной кислоте и нагревают смесь. Реакция приводит к образованию сульфата серебра в виде осадка, который можно собрать, промыть и высушить.
Важно отметить, что данные методы синтеза следует проводить с соблюдением соответствующих мер безопасности, в том числе с использованием соответствующих защитных средств и работы в хорошо проветриваемом помещении.
Применение сульфата серебра
Сульфат дисеребра имеет несколько применений в различных областях благодаря своим уникальным свойствам. Вот некоторые из его распространенных применений:
- Фотография. В черно-белой фотографии фотографы используют диаргентсульфат в качестве компонента светочувствительных эмульсий для захвата и проявления изображений путем реакции со светом.
- Аналитическая химия: различные аналитические методы используют сульфат серебра в качестве реагента для обнаружения и количественного определения галогенидов, таких как ионы хлорида и бромида, посредством реакций осаждения.
- Гальваника. В процессах гальваники используется сульфат диаргента для нанесения слоя серебра на проводящие поверхности, создания декоративных или защитных покрытий на ювелирных изделиях, электронных устройствах и других предметах.
- Антимикробный агент. Благодаря своим противомикробным свойствам диаргент сульфат находит применение в рецептурах повязок, мазей и медицинских изделий. Это помогает предотвратить инфекции и способствует заживлению.
- Аккумуляторная промышленность. Аккумуляторная промышленность использует его в качестве важнейшего компонента электродного материала для производства серебряно-цинковых и серебряно-кадмиевых батарей, которые широко распространены в электронных устройствах и медицинском оборудовании.
- Лабораторный реагент: Сульфат дисеребряна используется в качестве реагента в различных лабораторных экспериментах, включая синтез других соединений серебра и в реакциях органической химии.
- Производство стекла: В производстве стекла он играет жизненно важную роль в производстве специального стекла, в том числе посеребренных зеркал и проводящих оконных покрытий. Производители наносят тонкий слой диаргента сульфата для достижения желаемых свойств.
- Катализатор: Сульфат дисеребра действует как катализатор в некоторых химических реакциях, включая реакции окисления и процессы полимеризации.
Вопросы:
Вопрос: Что еще получается в реакции замещения нитрата серебра и сульфата калия?
Ответ: В реакции замещения AgNO3 и K2SO4 образуются нитрат калия (KNO3) и дисульфат серебра (Ag2SO4).
Вопрос: Если в раствор добавить еще твердый сульфат серебра, растворится ли он?
О: Да, дополнительный твердый сульфат дисеребряна растворится в растворе, так как он плохо растворяется в воде.
В: Выпадает ли осадок при сочетании нитрата серебра + сульфата натрия?
О: Да, осаждение происходит при реакции AgNO3 с сульфатом натрия, в результате чего образуется твердый осадок Ag2SO4.
Вопрос: Каков процент серебра в сульфате серебра?
Ответ: Процент Ag в диаргент-сульфате составляет примерно 63,48%.
Вопрос: Сульфат серебра растворим или нерастворим?
О: Диаргент сульфат плохо растворяется в воде.
Вопрос: Как найти химическую формулу сульфата серебра?
A: Химическая формула дисульфата серебра — Ag2SO4, которую можно определить по валентности катиона Ag+ и аниона SO4-2.
Вопрос: Какого цвета Ag2SO4?
A: Сульфат серебра (Ag2SO4) представляет собой белое твердое вещество.
Вопрос: Каково значение Ksp для Ag2SO4, если 5,49 г растворимы в 1,00 л воды?
Ответ: Значение константы произведения растворимости (Ksp) для Ag2SO4 можно рассчитать, используя предоставленную информацию, но для этого необходимы дополнительные данные о диссоциации Ag2SO4 в воде.
Вопрос: Какова молярная масса Ag2SO4?
A: Молярная масса Ag2SO4 составляет примерно 311,81 г/моль.
Вопрос: Образуется ли твердое вещество Ag2SO4 при растворении 2,7 г в 100 мл воды?
О: Да, некоторое количество твердого Ag2SO4 может образоваться, если его растворимость превышает предел растворимости диаргентного сульфата в 100 мл воды.
