Перхлорат натрия – химическое соединение формулы NaClO4. Это белое кристаллическое твердое вещество, хорошо растворимое в воде и обычно используемое в качестве окислителя в различных промышленных процессах.
| Название ИЮПАК | Перхлорат натрия |
| Молекулярная формула | NaClO4 |
| Количество CAS | 7601-89-0 |
| Синонимы | Хлорная кислота, натриевая соль; Перхлорат натрия (французский); Перхлорат натрия (немецкий); Perclorato di sodio (итальянский); Perclorato sodico (испанский); ООН 1502 |
| ИнЧИ | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Свойства перхлората натрия
Формула перхлората натрия
Химическая формула перхлората натрия – NaClO4. Это означает, что соединение состоит из одного атома натрия, одного атома хлора и четырех атомов кислорода. Перхлорат натрия — мощный окислитель, широко используемый в различных промышленных процессах.
Молярная масса перхлората натрия
Молярная масса NaClO4 составляет 122,44 г/моль. Это значит, что в одном моле NaClO4 содержится 122,44 грамма соединения. Молярная масса соединения важна для определения количества вещества, необходимого для химической реакции.
Температура кипения перхлората натрия
Температура кипения NaClO4 составляет 545°С (1013 гПа). Это температура, при которой соединение переходит из жидкого состояния в газообразное. NaClO4 имеет высокую температуру кипения из-за сильных электростатических сил между ионами натрия и перхлората.
Перхлорат натрия Температура плавления
Температура плавления NaClO4 составляет 482°С. Это температура, при которой соединение переходит из твердого состояния в жидкое. NaClO4 имеет высокую температуру плавления из-за сильных электростатических сил между ионами натрия и перхлората.
Плотность перхлората натрия г/мл
Плотность NaClO4 составляет 2,52 г/мл. Это означает, что один миллилитр NaClO4 весит 2,52 грамма. Плотность вещества важна для определения его физических свойств, таких как плавучесть и вязкость.
Молекулярный вес перхлората натрия
Молекулярная масса NaClO4 составляет 122,44 г/моль. Это сумма атомных масс атомов натрия, хлора и кислорода в соединении. Молекулярная масса соединения важна для определения его физических и химических свойств.
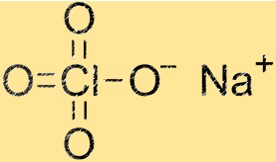
Структура перхлората натрия
Структура NaClO4 представляет собой кристаллическую решетку, состоящую из катионов Na+ и анионов ClO4-. Катионы натрия окружены четырьмя атомами кислорода, а анионы ClO4- состоят из одного атома хлора и четырех атомов кислорода. Структура кристаллической решетки придает NaClO4 характерные физические и химические свойства.
Растворимость перхлората натрия
NaClO4 хорошо растворим в воде, его растворимость составляет 209 г/100 мл при 20°C. Это означает, что большое количество NaClO4 может раствориться в небольшом количестве воды. Высокая растворимость NaClO4 делает его полезным в различных промышленных процессах, например, при производстве перхлората аммония для ракетного топлива.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,52 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 122,44 г/моль |
| Плотность | 2,52 г/мл |
| Точка плавления | 482°С |
| Точка кипения | 545°С (1013 гПа) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 209 г/100 мл при 20°С |
| Растворимость | Растворим в воде и этаноле |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нет в наличии |
Безопасность и опасность перхлората натрия
NaClO4 — опасное соединение, с которым следует обращаться осторожно. Это сильный окислитель, который может бурно реагировать с органическими материалами, восстановителями и другими химическими веществами. Воздействие пыли или паров NaClO4 может вызвать раздражение глаз, кожи и дыхательных путей. Проглатывание NaClO4 может вызвать раздражение желудочно-кишечного тракта, тошноту и рвоту. NaClO4 также вреден для водной флоры и фауны, и его необходимо утилизировать надлежащим образом. При работе с NaClO4 следует надевать средства индивидуальной защиты, такие как перчатки, очки и респиратор, чтобы избежать воздействия. Правильная вентиляция и хранение также важны для минимизации риска несчастных случаев.
| Символы опасности | О, Хн |
| Описание безопасности | Не вдыхать пыль/дым/газ/туман/пары/спрей. Надевайте защитные перчатки/защитную одежду/защиту глаз/лица. ПРИ ВДЫХАНИИ: Вынесите пострадавшего на свежий воздух и обеспечьте покой в удобном для дыхания положении. ПРИ ПРОГЛАТЫВАНИИ: Прополоскать рот. Не вызывает рвоту. Если вы плохо себя чувствуете, позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу. |
| Идентификационные номера ООН | ООН1502 |
| код ТН ВЭД | 2829.90.90 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании, вредно при вдыхании или попадании на кожу. Может вызвать раздражение или коррозию. |
Методы синтеза перхлората натрия
Различные методы позволяют синтезировать NaClO4.
Распространенный метод включает реакцию хлората натрия с соляной кислотой , в результате которой образуются NaClO4 и хлорид натрия .
Другой метод включает электролиз раствора хлорида натрия в присутствии перхлората. Происходит превращение хлорида натрия в хлорат натрия с последующим добавлением соляной кислоты, которая превращает его в NaClO4.
Другой подход заключается во взаимодействии хлората натрия с хлоридом натрия в присутствии серной кислоты. Этот метод дает смесь NaClO4 и сульфата натрия, которую можно разделить фракционной кристаллизацией.
Другой метод включает реакцию хлората натрия с перхлоратом аммония, в результате которой образуются NaClO4 и хлорид аммония. Этим методом осуществляется производство NaClO4, обычно используемого в качестве окислителя в твердом ракетном топливе.
Реакция гипохлорита натрия с хлоратом натрия в присутствии соляной кислоты также приводит к синтезу NaClO4. В результате этого метода в качестве основных продуктов получают NaClO4 и хлорид натрия.
Использование перхлората натрия
NaClO4 находит различное применение в разных отраслях промышленности. Вот некоторые распространенные применения NaClO4:
- Ракетное топливо: обычно используется в качестве окислителей в твердом ракетном топливе из-за высокого содержания кислорода и высокой стабильности.
- Пиротехника: используется в качестве окислителя в пиротехнических составах, таких как сигнальные ракеты, фейерверки и сигнальные ракеты.
- Аналитическая химия: используется в качестве источника перхлорат-ионов в аналитической химии для определения ионов в различных образцах.
- Гальваника: используется в качестве компонента гальванических растворов для улучшения проводимости и стабильности гальванической ванны.
- Батареи: используется в качестве электролита в литий-ионных батареях из-за его высокой растворимости и способности улучшать электрохимические свойства батареи.
- Медицинское применение: используется при лечении заболеваний щитовидной железы в качестве конкурентного ингибитора транспорта йода. Также используется при производстве контрастных веществ для медицинской визуализации.
- Водоочистка: используется при очистке воды в качестве дезинфицирующего средства и для удаления определенных загрязнений из воды.
Вопросы:
Вопрос: Какова формула перхлората натрия?
Ответ: NaClO4.
Вопрос: Растворим ли перхлорат натрия в воде?
Ответ: Да, NaClO4 хорошо растворяется в воде.
Вопрос: Перхлорат натрия – это кислота или основание?
Ответ: NaClO4 не является ни кислотой, ни основанием. Это соль.
Вопрос: Какова реакция перхлората аммония и бромида натрия?
A: Реакция: NH4ClO4 + NaBr → NaClO4 + NH4Br.
Вопрос: Сколько ионов натрия содержится в перхлорате натрия?
Ответ: В NaClO4 есть ион натрия.
Вопрос: NaClO4 – это кислота или основание?
Ответ: NaClO4 не является ни кислотой, ни основанием. Это соль.
Вопрос: Какие растворенные вещества присутствуют в растворе NaClO4?
Ответ: В растворе NaClO4 растворенными веществами являются ионы Na+ и ClO4-.
Вопрос: Сколько молей кислорода содержится в 3,30 молях NaClO4?
Ответ: В 3,30 молях NaClO4 содержится 13,2 моля кислорода.
Вопрос: Растворим ли NaClO4 в воде?
Ответ: Да, NaClO4 хорошо растворяется в воде.
Вопрос: Сколько молей кислорода содержится в 1,10 молях NaClO4?
Ответ: В 1,10 молях NaClO4 содержится 4,4 моля кислорода.
