Перхлорат кальция (Ca(ClO4)2) представляет собой химическое соединение, которое имеет множество применений, в том числе в фейерверках и ракетном топливе. Он хорошо растворим в воде и может также использоваться в качестве осушителя.
| Название ИЮПАК | Перхлорат кальция |
| Молекулярная формула | Са(ClO4)2 |
| Количество CAS | 13477-36-6 |
| Синонимы | Кальциофос, кальциевая соль хлорной кислоты, диперхлорат кальция, перхлорат кальция (II), UN1459 |
| ИнЧИ | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Свойства перхлората кальция
Формула перхлората кальция
Формула перхлората кальция: Ca(ClO4)2. Он состоит из одного иона Ca2+ и двух ионов ClO4-. Ион кальция имеет положительный заряд 2+, а каждый ион ClO4- имеет отрицательный заряд 1-. Эта формула используется для представления химической структуры перхлората кальция.
Молярная масса перхлората кальция
Молярная масса Ca(ClO4)2 составляет 238,98 г/моль. Эта величина представляет собой массу одного моля Ca(ClO4)2, содержащего число молекул Авогадро. Молярная масса важна при определении количества Ca(ClO4)2, необходимого в конкретной реакции.
Температура кипения перхлората кальция
Ca(ClO4)2 не имеет точки кипения, поскольку он разлагается, не достигнув точки кипения. При нагревании он разлагается на хлорид кальция, газообразный кислород и газообразный хлор. Эта реакция разложения является сильно экзотермической и выделяет значительное количество тепла.
Перхлорат кальция Температура плавления
Температура плавления Ca(ClO4)2 составляет 200°С. Эта температура является точкой, при которой твердый Ca(ClO4)2 переходит в жидкое состояние. Температура плавления важна для определения физических свойств Ca(ClO4)2, например, его способности использоваться в качестве осушителя.
Плотность перхлората кальция г/мл
Плотность Ca(ClO4)2 составляет 2,505 г/мл. Это значение представляет собой количество массы в единице объема Ca(ClO4)2. Плотность Ca(ClO4)2 больше плотности воды, а значит, он тонет в воде.
Молекулярный вес перхлората кальция
Молекулярная масса Ca(ClO4)2 составляет 238,98 г/моль. Эта величина представляет собой сумму атомных весов всех атомов молекулы Ca(ClO4)2. Молекулярная масса важна для определения количества Ca(ClO4)2, необходимого в конкретной реакции.
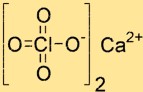
Структура перхлората кальция
Структура Ca(ClO4)2 состоит из одного иона Ca2+ и двух ионов ClO4-. Ион Ca2+ расположен в центре структуры и окружен четырьмя атомами кислорода, происходящими от двух ионов ClO4-. Ионы ClO4- имеют тетраэдрическую форму и связаны с ионом кальция атомами кислорода.
Растворимость перхлората кальция
Ca(ClO4)2 хорошо растворим в воде, растворимость 121 г/100 мл при 20°C. Эта растворимость делает его полезным в качестве осушающего агента, поскольку он может поглощать воду из окружающей среды. Однако он нерастворим в органических растворителях, таких как этанол и ацетон.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2505 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 238,98 г/моль |
| Плотность | 2505 г/мл |
| Точка плавления | 200°С |
| Точка кипения | Разлагается до точки кипения |
| Мигающая точка | Непригодный |
| Растворимость в воде | 121 г/100 мл при 20°С |
| Растворимость | Нерастворим в органических растворителях |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Непригодный |
Безопасность и опасность перхлората кальция
Ca(ClO4)2 представляет несколько рисков для безопасности, поэтому при обращении с ним следует принять соответствующие меры безопасности. Это сильный окислитель, который может вступать в реакцию с легковоспламеняющимися материалами, вызывая пожар или взрыв. Вдыхание его пыли или паров может вызвать раздражение дыхательных путей, а контакт с кожей может вызвать раздражение или ожоги. Он также вреден при проглатывании, вызывая раздражение или коррозию пищеварительного тракта. При работе с Ca(ClO4)2 следует использовать соответствующие средства индивидуальной защиты, такие как перчатки и очки, и хранить их вдали от легковоспламеняющихся и несовместимых веществ.
| Символы опасности | Окислитель, вреден при проглатывании |
| Описание безопасности | Хранить вдали от легковоспламеняющихся материалов и несовместимых веществ. Наденьте перчатки и защитные очки. Избегайте вдыхания пыли и паров. В случае попадания промыть большим количеством воды и при необходимости обратиться к врачу. |
| Идентификационные номера ООН | ООН1502 |
| код ТН ВЭД | 2829,9000 |
| Класс опасности | 5.1 – Окисляющие вещества |
| Группа упаковки | II |
| Токсичность | Вреден при проглатывании, раздражает кожу и дыхательную систему. |
Методы синтеза перхлората кальция
Ca(ClO4)2 можно синтезировать взаимодействием гидроксида кальция с хлорной кислотой или перхлоратом аммония.
Один метод включает реакцию карбоната кальция с хлорной кислотой в реакционном сосуде с последующей фильтрацией и выпариванием раствора с получением твердого продукта.
Другой метод предполагает реакцию оксида кальция с водным раствором хлорной кислоты с последующей фильтрацией и сушкой полученного продукта.
В некоторых случаях Ca(ClO4)2 можно синтезировать путем взаимодействия хлорида кальция с перхлоратом натрия в реакционном сосуде. Продукт можно отфильтровать и высушить, чтобы получить после реакции Ca(ClO4)2.
Другой популярный метод синтеза Ca(ClO4)2 включает реакцию хлорида кальция с перхлоратом аммония, в результате которой в качестве побочных продуктов образуются Ca(ClO4)2 и хлорид аммония. Пиротехнические применения предпочитают этот метод из-за его способности производить Ca(ClO4)2 высокой чистоты.
Важно отметить, что при работе с хлорной кислотой необходимо соблюдать соответствующие меры безопасности, так как она является сильным окислителем, способным вступать в реакцию с органическими материалами, вызывая пожар или взрыв.
Использование перхлората кальция
Ca(ClO4)2 имеет множество применений в различных отраслях промышленности и применениях. Некоторые из применений Ca(ClO4)2:
- Пиротехника: обычно используется в пиротехнике в качестве окислителя из-за высокого содержания кислорода и стабильности.
- Удобрение: используется в удобрениях для обеспечения растений кальцием и хлором, которые являются важными питательными веществами для их роста.
- Ракетное топливо: используется в качестве компонента ракетного топлива из-за высокого содержания кислорода и стабильности.
- Нефтепереработка: используется в нефтяной промышленности для удаления соединений серы из сырой нефти и других углеводородов.
- Надуватели подушек безопасности: используются при производстве надувателей подушек безопасности из-за их способности быстро выходить из строя и выделять газ.
- Факелы: используются при производстве факелов из-за высокого содержания кислорода и стабильности.
- Обработка поверхности металла: используется при обработке металлических поверхностей для удаления ржавчины и других загрязнений.
- Лабораторное применение: используется в различных лабораторных целях, например, при получении хлорной кислоты и в качестве осушителя.
Вопросы:
Вопрос: Какова формула перхлората кальция?
А: Са(ClO4)2.
Вопрос: Перхлорат кальция ионный или ковалентный?
Ответ: Ca(ClO4)2 является ионным соединением, поскольку состоит из катионов кальция (Ca2+) и перхлорат-анионов (ClO4-).
Вопрос: Как утилизировать перхлорат кальция?
Ответ: Ca(ClO4)2 можно удалить, промыв пораженный участок водой, а затем нейтрализовав оставшиеся следы соединения слабым основанием, например бикарбонатом натрия.
Вопрос: Растворим ли перхлорат кальция?
О: Да, Ca(ClO4)2 растворим в воде и других полярных растворителях. Его растворимость в воде составляет примерно 120 г на 100 мл воды при комнатной температуре.
Вопрос: Какие реакции производят перхлорат кальция и вода?
Ответ: Ca(ClO4)2 и вода при обычных условиях не реагируют друг с другом.
Вопрос: Сколько атомов хлора содержится в 0,650 молях Ca(ClO4)2?
A: В 0,650 молях Ca(ClO4)2 содержится 5,88 x 10^23 атомов хлора.
Вопрос: Какова молярная масса Ca(ClO4)2?
A: Молярная масса Ca(ClO4)2 составляет 238,98 г/моль.
Вопрос: Каков коэффициент активности H в растворе, содержащем 0,073 М HCl и 0,0090 М Ca(ClO4)2?
А: Коэффициент активности H в растворе, содержащем 0,073 М HCl и 0,0090 М Ca(ClO4)2, зависит от температуры и других факторов. Его можно рассчитать с использованием термодинамических моделей и экспериментальных данных.
Вопрос: Сколько молей содержится в 26,0 граммах Ca(ClO4)2?
Ответ: В 26,0 граммах соединения содержится 0,109 моль Ca(ClO4)2.
